Теплота (тепловой эффект) реакции - это количество тепловой энергии, выделившееся или поглощенное системой в результате протекающих в ней химических превращений.
Тепловой эффект обозначается символами Q или ΔH (Q = -ΔH). Реакции, идущие с выделением теплоты (Q > 0; ΔH < 0), относятся к экзотермическим, а с ее поглощением (Q < 0; ΔH > 0) - к эндотермическим. Химические уравнения, для которых указаны тепловые эффекты, называются термохимическими уравнениями. Например:
Н2(г) + 1/2О2(г) = Н2О(ж), 
где г – газ, ж – жидкость, r означает, что изменение энтальпии относится к химической реакции, (298) – температура системы; правый верхний индекс (о) указывает на стандартное состояние веществ, участвующих в реакции.
На теплоту образования веществ влияет их агрегатное и фазовое. Поэтому в термохимических уравнениях принято указывать это состояние (г - газ, ж - жидкость, т - твердое вещество, к - кристаллическая фаза).
В основе термохимических расчетов лежит закон постоянства количества теплоты, открытый русским химиком Г.И. Гессом в 1840 г.
|
|
|
Тепловой эффект реакции зависит только от начального и конечного состояний реагирующих веществ и не зависит от пути реакции (т.е. от числа стадий и промежуточных состояний).
Закон Гесса. Открыт в 1840 г российским ученым Г.И.Гессом. Тепловой эффект реакции, протекающей при постоянном давлении или постоянном объеме не зависит от пути протекания реакции и определяется только природой и состоянием исходных веществ и конечных продуктов.
Рассмотрим процесс получения оксида углерода (IV) из графита:

Эту же реакцию можно осуществить в две стадии через образование оксида углерода (II):

Эти реакции можно представить следующей схемой:
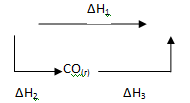
В соответствии с законом Гесса можно записать:
ΔН1= ΔН2 + ΔН3 или ΔН1 - ΔН2 - ΔН3 = 0. (2.9)
Процессы, в которых система после ряда последовательных превращений возвращается в исходное состояние, называются круговыми процессами или термодинамическими циклами. Метод циклов используется для вычисления различных термодинамических свойств веществ.
Первое следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ. Энтальпия образования вещества В() это энтальпия реакции образования 1 моль соединения из простых веществ, устойчивых при стандартных условиях. Например. энтальпия образования нитрата натрия равна энтальпии реакцииNa(кр) + ½N2(г) + 3/2О2(г) = NaNO3(кр), 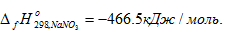 Энтальпия образования простых веществ при стандартных условиях принята равной нулю. Энтальпия является свойством вещества, также как и масса, объем и т.д. Энтальпия _ функция состояния системы, т.е. ее изменение не зависит от пути процесса, а определяется только состоянием системы в конце и начале процесса.
Энтальпия образования простых веществ при стандартных условиях принята равной нулю. Энтальпия является свойством вещества, также как и масса, объем и т.д. Энтальпия _ функция состояния системы, т.е. ее изменение не зависит от пути процесса, а определяется только состоянием системы в конце и начале процесса.
|
|
|
Энтальпия химической реакции в общем виде аА + bB = dD + eE (2.10)
определяется по уравнению 
Второе следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Энтальпия сгорания вещества В 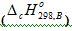 это энтальпия реакции окисления кислородом 1 моль соединения до образования высших оксидов. Например энтальпия реакции сгорания метанола есть изменение энтальпии следующей реакции: СН3ОН + 3/2О2 = СО2 + 2Н2О
это энтальпия реакции окисления кислородом 1 моль соединения до образования высших оксидов. Например энтальпия реакции сгорания метанола есть изменение энтальпии следующей реакции: СН3ОН + 3/2О2 = СО2 + 2Н2О
Энтальпия химической реакции в общем виде (2.10) определяется по уравнению
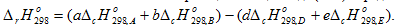
 2018-01-21
2018-01-21 793
793








