По степени убывания кислорода оксиды железа располагаются в ряд: Fe2О3, Fe3O4 и FeO, содержащие соответственно 30,06; 27,64 и 22,28% кислорода. В этом же направлении возрастает и химическое сродство к кислороду, т. е. из трех оксидов железа, взятых в свободном состоянии, наиболее прочным в условиях рабочего пространства доменной печи, а точнее при температуре выше 570°С, является FeO. Восстановление железа из его оксидов протекает ступенчато путем последовательного удаления кислорода ив зависимости от температуры может быть изображено двумя схемами:
при температуре >570°С, Fe2О3 → Fe3О4 → FeO → Fe,
при температуре <570°С, Fe203 → Fe304 → Fe.
Ниже температуры 570°С (843° К) прочность FeO становится меньше прочности Fe3О4 и она превращается в Fe3О4 и Fe (4FeО → Fe3О4 → Fe).
В доменной печи восстановление железа из его оксидов протекает в основном по первой схеме, так как уже через, несколько минут после загрузки материалов на колошник они нагреваются до температуры выше 570° С. Большая половина кислорода, связанного в окислах железа, отбирается оксидом углерода, поэтому основным восстановителем в доменной печи является оксид углерода.
Восстановление оксидов железа оксидом углерода при температуре ниже 5700 С идет по реакциям:
3Fe2О3 + CO → 2Fe3О4 + CО2 + 8870 ккал, (6.3)
Fe3О4 + kCO = 3Fe + (k-4)CO + 4CO2 +17,166 МДж (4100 ккал). (6.4)
При температуре выше 570° С восстановление идет по реакциям
3Fe2О3 + CO → 2Fe3О4 + CО2 + 37,137 МДж (8870 ккал), (6.5)
Fe3О4 + m CO = 3FeО + (m-1) CO + CО2 – 20,892 МДж (4490 ккал), (6.6)
FeО + n CO = Fe + (n - 1) CO + CО2 + 13,607 МДж (3250 ккал). (6.7)
Суммарный тепловой эффект реакций непрямого восстановления оксидом углерода положительный. Наиболее легковосстановимым окислом является Fe2О3. Упругость диссоциации ее настолько велика, что реакция (6.4) идет необратимо в сторону образования Fe3О4 при любом соотношении окиси и двуокиси углерода в газовой фазе почти до полного превращения СО в СО2 или Fe2О3 в Fe3О4. Остальные реакции могут протекать в обоих направлениях в зависимости от температуры и соотношения СО и СО2 в газовой фазе, так как оксиды Fe3О4 и FeO намного прочнее, чем оксид Fe2О3. Для их восстановления необходимо, чтобы отношение СО к СО2 в газовой фазе всегда было больше определенного значения, при котором возможно протекание реакций слева направо. В уравнениях реакций (6.4, 6.6 и 6.7) это условие отражается коэффициентами k, m и п при СО.
Для каждой температуры при определенном соотношении СО и СО2 в газовой смеси в реакциях 6.5 - 6.7 устанавливается равновесие. Газовые смеси, находящиеся в равновесии с восстанавливаемыми оксидами, называются равновесными или нейтральными смесями.

Рисунок 6.2 - Кривые равновесия газовых смесей СО и СО2 с оксидами железа и железом
На рисунке 6.2 приведена диаграмма равновесий тазовых смесей СО и СО2 с оксидами железа и железом.. На горизонтальной оси абсцисс: температура, на вертикальной отношение СО/СО2 т. е. газовая фаза состоит только из СО и СО2, причем сумма их всегда равна 100.
Равновесная линяя 1 реакции (6.5) сливается с осью абсцисс, т.к. кравновесие реакции достигается при очень низкой концентрации СО в газовой смеси.
Равновесие реакций (6.6) и (6.7) с повышением температуры характеризуется восходящими кривыми 2 и 3, а равновесие реакции (6.7) – нисходящей кривой 4. Следовательно, при восстановлении Fe3О4 до Fe и FeO до Fe содержание СО в равновесной смеси с увеличением температуры возрастает – возрастают значения k и n в реакциях (6.5) и (6.7), а при восстановлении Fe3О4 до FeO с повышением температуры содержание СО убывает - уменьшается значение m в реакции (6.3).
Равновесное изменение состава газовой смеси при изменении температуры, а следовательно, конфигурация кривых равновесия на диаграмме зависят от знака теплового эффекта реакций.
Принцип Ле-Шателье: всякое внешнее воздействие на равновесную систему смещает равновесие в направлении, противодействующем внешнему воздействию. При повышении температуры равновесие реакции смещается в направлении образования веществ сопровождающемся поглощением тепла, и, наоборот, при понижении температуры – в направлении образования веществ, сопровождающемся выделением тепла.
Равновесные линии делят диаграмму на три поля: Fe, FeO и Fe3О4. Четвертое поле Fe2О3 на диаграмме отсутствует, так как равновесная линия 1 сливается с осью абсцисс.
Любая точка на кривых характеризует положение равновесия той или иной реакции, а каждая точка вне кривых – нейтральный состав газовой смеси только для того вещества, в поле которого находится точка. Например, если в поле устойчивого существования FeO поместить Fe, FeO и Fe3О4 то железо окислится до FeO, Fe3О4 восстановится до FeO, a FeO останется без изменения. Реакции будут протекать до тех пор, пока не израсходуется тот или иной реагент или пока газовая смесь не станет равновесной.
Пример 1. В газ, содержащий 30% СО и 70% СО2, при 1000° С (точка а на рисунке) поместили Fe3О4. Так как в этих условиях устойчива только FeO, то Fe3О4 будет восстанавливаться, обогащая газовую смесь диоксидом углерода до тех пор, пока газ не достигнет равновесного состава, отвечающего точке б на кривой 4 (83% СО2 и 17% СО). Если же Fe3О4 израсходуется раньше, чем будет достигнуто равновесие, то реакция прекратится и газовая смесь будет иметь состав, соответствующий некоторой точке между точками а и б.
Пример 2. При тех же исходных условиях (точка а), но при неизменном составе газа будем изменять температуру. До тех пор, пока изменение температуры происходит в поле FеО, никаких других изменений не произойдет. При понижении температуры до 750° С (точка в) газовая смесь окажется в равновесии с FeO и Fe3О4. Дальнейшее понижение температуры вызовет в соответствии с принципом Ле-Шателье протекание экзотермической реакции:
3FeO + CO2 → Fe3О4 + CO (6.8)
и изменение состава газовой смеси в сторону возрастания СО и убывания СО2. На диаграмме это изменение выразится перемещением состава по кривой 4 вверх. Если FeO будет израсходовано, например, в точке г, то установится постоянный состав газовой смеси. При дальнейшем понижении температуры процесс переходит в поле Fe3О4 по горизонтали в направлении гд.
Пользуюсь условиями равновесия и принципом Ле-Шателье, можно анализировать возможность протекания реакций в любой области диаграммы, а также определять численные значения коэффициентов к, m и n в реакциях (6.6) – (6.7).
Определим, например, значение n в реакции (6.7) при температуре 1000° С. Равновесная газовая смесь для этой реакции при 1000° С состоит из 72% СО и 28% СО2. Определим отношение компонентов равновесной газовой смеси:
 . (6.9)
. (6.9)
Подставим в выражение (11) вместо СО и СО2 коэффициенты (n – 1) и 1, стоящие при СО и СО2 в правой части реакции (6.7). Тогда n – 1/1=2,57, а n = 3,57.
Это значит, что при 1000° С и n, равном 3,57, реакция (6.7) будет находиться в равновесии. При n >3,57 FeO будет восстанавливаться до Fe, а при n < 3,57 железо будет окисляться до FeO. Аналогично для каждой температуры можно определить значения k и m.
В присутствии углерода между СО и СО2 устанавливается равновесие в соответствии с обратимой реакцией
2CO = СО2 + С + 39600 ккал. (6.10)
Так как реакции (6.10) протекает с изменением объема газообразных веществ, то положение равновесия определяется не только температурой, но и давлением. В соответствии с принципом Ле-Шателье при повышении давления равновесие реакции (6.10) смещается в направлении образования веществ, сопровождающемся уменьшением объема, т. е. в направлении образования СО2 и С, и, наоборот, с уменьшением давления – в направлении образования СО.
В доменной печи восстановление железа из его оксидов и превращение окиси и двуокиси углерода в присутствии избытка углерода совершается совместно. Поэтому, анализ диаграммы равновесия реакций (6.5 – 6.7) необходимо вести с учетом кривой равновесия реакции (6.10).
Положение равновесной кривой 5 на рисунке определяется давлением газовой системы, равным 98 кН/м2 (1 атм.). Видно, что состав газовой смеси из СО и СО2, равновесной с углеродом, сильно изменяется с изменением температуры, особенно в интервале 550 – 800°.
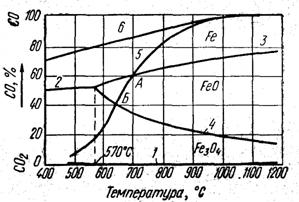
Рисунок 6.3 - Кривые равновесия газовых смесей СО и СО2 с оксидами железа, железом и углеродом
Равновесная кривая 5 реакции (6.10) делит диаграмму на две области – левую и правую, в которых система в большей или меньшей мере удалена от положения равновесия. В левой области реакция идет в направлении образования СО2 и сажистого углерода за счет разложения СО и, естественно, затрудняет течение восстановительного процесса. В правой области реакция идет в направлении обогащения смеси оксидом углерода за счет расходования диоксида углерода и углерода. Здесь процесс восстановления облегчается, так как образующийся газообразный продукт восстановления – диоксид углерода – непрерывно расходуется в реакции:
СО2 + С→2СО, (6.11)
обогащая газовую смесь восстановителем СО. Эта реакция идет очень быстро при температуре около 1000° С и выше. Учитывая влияние реакции (6.10) на состав газовой смеси, равновесие реакций (6.5) – (6.7) слева и справа от кривой 5 является неустойчивым при условии, что реакция (4.10) идет с большей скоростью, чем реакции (6.5) – (6.7). Слева от кривой 5 реакции будут идти в сторону превращения Fe и FeO в Fe3О4, а справа – в сторону превращения Fe3О4 в FeO и FeO в Fe. Равновесие веществ, входящих в обе системы, возможно лишь в точках А и Б, образуемых пересечением кривой 5 с кривыми 3 и 4.
В доменной печи состав газов, описываемый равновесием реакции (6.10), достигается лишь при температуре около 1000 С. При понижении температуры состав реального доменного газа значительно отличается от равновесного как вследствие кратковременности пребывания газа в зоне температур 400 – 600° С, где идет превращение СО в СО2 и сажистый углерод, так и вследствие малой скорости этого превращения. Поэтому действительный состав, газа в доменной печи в пересчете только на СО и СО2 описывается линией 6 на рисунке 6.3. При низких температурах, т. е. в верхней части доменной печи, действительное содержание СО в газе значительно выше равновесного, что создает благоприятные условия для восстановления железа из его оксидов в этой зоне печи.
Рассмотрим влияние разложения окиси углерода на процесс восстановления. Реакция 2СО → СО2 + С наиболее интенсивно идет при 400 – 6000 С в присутствии свежевосстановленного железа. Она позволяет улучшить использование углерода в печи. Если бы реакция не шла, то оба атома углерода в виде продукта неполного сгорания СО были бы унесены из печи колошниковым газом. При разложении же СО один из атомов углерода превращается в продукт полного сгорания СО2, а другой участвует в процессе восстановления. Выделившийся сажистый углерод – очень активный восстановитель. При 600 – 700° С он уже энергично взаимодействует с оксидом железа по реакции:
FeO + C → Fe+CO. (6.12)
Суммируя эту реакцию с реакцией распада окиси углерода, получаем реакцию непрямого восстановления:
FeO+C → Fe+CO
+
2CО → CО 2 +C
FeO + СО → Fe +CО2. (6.13)
Образовавшийся на более высоких горизонтах сажистый углерод при опускании материалов в ДП полностью используется. Происходит кругооборот вещества, связанный с переносом тепла, выделяющегося при распаде СО в верхних горизонтах и поглощающегося при использовании сажистого углерода в роли восстановителя на более низких горизонтах. Реакция разложения окиси углерода также играет важную роль в процессе науглероживания металла, о чем будет сказано ниже.
Отрицательные последствия этой реакции состоят в снижении восстановительной способности доменного газа в верхней части лечи вследствие уменьшения концентрации СО и увеличения концентрации СО2 в общем газе.
С увеличением давления газов в рабочем пространстве доменной печи скорость разложения окиси углерода возрастает и тем интенсивнее, чем больше отношение СО/СО2 в газе.
 2018-01-21
2018-01-21 1844
1844
