Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются нервная ткань, печень, кишечник, мышцы. Основными его источниками:
• неокислительное дезаминирование некоторых аминокислот(серина, треонина, гистидина) в печени;
• дезаминирование амидов глутаминовой и аспарагиновой кислот– в печени и поч-ках;
• катаболизм биогенных аминов– во всех ткани, в наибольшей степени в нервной ткани;
• жизнедеятельность бактерий толстого кишечника
• распад пуриновых и пиримидиновых оснований– во всех тканях.
• синтез глутаминовой к-ы– происходит практически во всех тканях, но имеет небольшое значе-ние
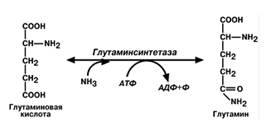
• синтез глутамина– главный способ уборки. Наиболее активно происходит в нервной и мышечной
тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях;
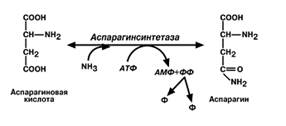
• синтез аспарагина– является вто-ростепенным способом уборки ам-миака, энергетически невыгоден,
т.к. тратится2 макроэргические связи;
ТРАНСПОРТ АММИАКА
Транспортными формами аммиака являются глутамин, аланин, некоторое кол-во аммиака находится в крови в свобвиде. Большая часть глутамина поступает от мышц и мозга, аланин-от мышц и ст кишечника. Роль глутамина
Образование большого количества глутамина при обезвреживании аммиака обеспечивает высокие концентрации этого вещества в крови(0,5-0,7 ммоль/л). Так как глутамин проникает через клеточные мембраны путем облегченной диффузии, то он легко попадает не только в гепатоциты, но и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового и пиримидинового колец, ГМФ, аспарагина.
Целевыми органами для транспорта аммиака являются печень, почки и кишечник.
• в кишечнике часть глутамина дезаминируется, образованный аммиак выделяется в просвет кишечника(не более5%), часть поступает в печень, около90% – в мочу;
• в печени происходит синтез мочевины;
• в почках идет образование аммонийных солей.
СИНТЕЗ АММОНИЙНЫХ СОЛЕЙ 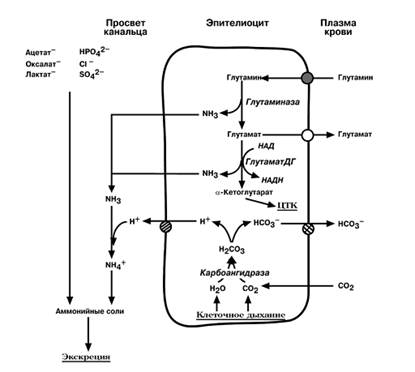
Часть глутамина крови, не задержавшаяся в печени, достигает почек. В клетках дистальных почечных канальцев имеется фермент глутаминаза, гидролизующая амидную группу в виде аммиака, с образованием глутамата. Глутамат в свою очередь, дезаминируется глутаматдегидрогеназой. Выделяемый аммиак диффундируетв просвет канальца, где соединяется с ионом Н+, образуя ионы аммонияNH4+. Онисвязываются с неорганическими(Cl– иSO42-), или с органическими анионами(ук-сусной, щавелевой, молочной кислот). При ацидозе(закислении крови) необходимость выведения ионов Н+ вызывает увеличение синтеза фермента и возрастание экскреции солей аммония. При алкалозе(защелачивании крови) количество глутаминазы снижается и ионы Н+ сберегаются в организме.
Токсичность аммиака обусловлена:
1. При синтезе глутамата происходит отток α-кетоглутарата из ЦТК, при этом понижается образование энергии АТФ и ухудшается деятельность клеток;
2. Ионы аммонияNH4+ вызывают защелачивание плазмы крови. При этом повышается сродство гемоглобина к кислороду(эффект Бора), гемоглобин не отдает кислород в капиллярах, в результате наступает гипоксия клеток;
3. Накопление свободного ионаNH4+в цитозоле влияет на работу внутриклеточных ферментов и ионных каналов для Na+ и K+;
4. Глутамин, являясь осмотически активным веществом, приводит к задержке воды в клетках и их набуханию, что вызывает отек тканей. В случае нервной ткани это может вызвать отек мозга
5. Использование глутамата для нейтрализации аммиака вызывает снижение синтеза ГАМК, тормозного медиатора нервной системы.
Орнитиновый цикл. Мочевина- полный амид угольной кислоты - содержит 2 атома азота.
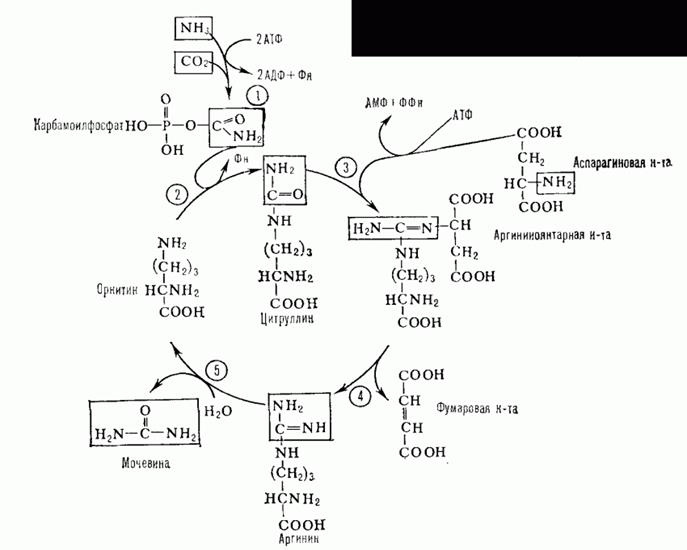
Суммарное уравнение синтеза мочевины: СО2 + NH3 + Аспартат + 3 АТФ + 2 Н2О → Мочевина + Фумарат + 2 (АДФ + Н3Р04 + АМФ + H4P2O7.
В печеночные клетки аммиак попадает в виде глутамина, глутаминовой кислоты, аланина, в свободном виде. Кроме этого, при метаболизме он образуется в большом количестве и в самих гепатоцитах. В печени весь аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при голодание, избыточные физические нагрузки, сахарный диабет или избыточном белковом питании.
Синтез мочевины начинается в митохондриях(первая и вторая реакции), оставшиеся три реакции идут в цитозоле. Для переноса цитруллина и орнитина через митохондриальную мембрану существуют специальные переносчики.
В образовании одной молекулы мочевины участвует1 молекулаNH3, 1 молекулаCO2, аминогруппа1 молекулы аспарагиновой кислоты, затрачивается4 макроэргических связи трех молекул АТФ.
В биологических жидкостях М. определяют с помощью газометрических методов, прямых фотометрических методов, основанных на реакции с образованием эквимолекулярных количеств окрашенных продуктов, а также ферментативных методов с использованием уреазы. Газометрические методы основаны на окислении М. гипобромитом натрия в щелочной среде NH2—СО—NH2 + 3NaBrO → N2 + CO2 + 3NaBr + 2H2O. Объем газообразного азота измеряют с помощью аппарата Бородина. Однако этот метод обладает низкой специфичностью и точностью. Из фотометрических наиболее распространены методы, основанные на реакции М. диацетилмонооксимом (реакция Ферона) в присутствии тиосемикарбазида и солей железа в кислой среде. Другим унифицированным методом определения М. является уреазный метод: NH2—СО—NH2 → уреазаNH3 +CO2. Выделившийся аммиак образует с гипохлоритом натрия и фенолом индофенол, имеющий синий цвет. Интенсивность окраски пропорциональна содержанию М. в исследуемой пробе. Уреазная реакция высокоспецифична, для исследования берут лишь 20 мкл сыворотки крови, разведенной в соотношении 1: 9 раствором NaCI. Иногда вместо фенола используют салицилат натрия; сыворотку крови разводят следующим образом: к 10 мкл сыворотки крови добавляют 0,1 мл NaCI. Ферментативная реакция протекает при 37° в течение 31/2 мин
 2017-11-01
2017-11-01 2592
2592
