Алканы
Алканы – это алифатические (ациклические), насыщенные углеводороды, в которых все валентности атомов углерода, не затраченные на образование простых С – С связей, насыщены атомами водорода.
Общая формула алканов – СnH2n+2
| Формула | Название | Название радикала |
| CH4 | метан | - CH3 метил |
| C2H6 | этан | - C2H5 этил |
| C3H8 | пропан | - C3H7 пропил |
| C4H10 | бутан | - C4H9 бутил |
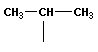
| C4H10 | изобутан | изобутил |
| C5H12 | пентан | пентил |
| C5H12 | изопентан | изопентил |
| C5H12 | неопентан | неопентил |
| C6H14 | гексан | гексил |
| C7H16 | гептан | гептил |
| C10H22 | декан | децил |
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2 -. Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
Гомологи – вещества сходные по строению и свойствам, но отличающиеся по составу на одну или несколько гомологических разностей (СН2-).
Строение
Ø пространственное строение – тетраэдрическое
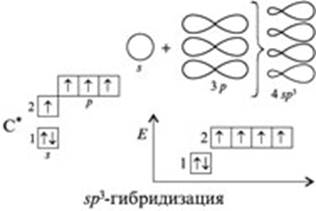
Ø sp3 – гибридизация
Ø угол связи = 109 ° 28′
Ø длина связи (-С-С-) 0,154 нм
Ø энергия связи (-С-С-) 348 кДж/моль
Все атомы углерода в молекулах алканов находятся в состоянии sр3-гибридизации, угол между связями С-C составляет 109°28', поэтому молекулы нормальных алканов с большим числом атомов углерода имеют зигзагообразное строение (зигзаг). Длина связи С-С в предельных углеводородах равна 0,154 нм (1нм=1*10-9м).
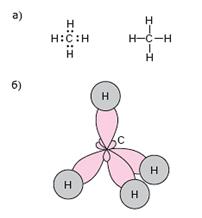
а) электронная и структурная формулы;
б) пространственное строение
Изомерия
Для алканов характерна структурная изомерия.
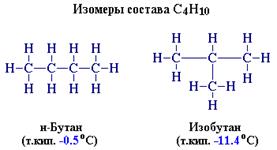
Один из этих изомеров (н-бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Атомы углерода в разветвленной цепи различаются типом соединения с другими углеродными атомами. Так, атом углерода, связанный только с одном другим углеродным атомом, называется первичным, с двумя другими атомами углерода – вторичным, с тремя – третичным, с четырьмя – четвертичным.
 С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.
С увеличением числа атомов углерода в составе молекул увеличиваются возможности для разветвления цепи, т.е. количество изомеров растет с ростом числа углеродных атомов.
Номенклатура
 Для названия предельных углеводородов применяют в основном систематическую (международная номенклатура IUPAC) и рациональную номенклатуры.
Для названия предельных углеводородов применяют в основном систематическую (международная номенклатура IUPAC) и рациональную номенклатуры.
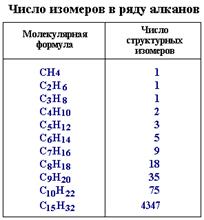
I. По рациональной номенклатуре алканы рассматривают как производные простейшего углеводорода — метана, в молекуле которого один или несколько водородных атомов замещены на радикалы. Эти заместители (радикалы) называют по старшинству (от менее сложных к более сложным). Если эти заместители одинаковые, то указывают их количество. В основу названия включают слово "метан":
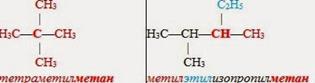
II. Систематическая номенклатура
Правила систематической номенклатуры:
1. В формуле молекулы алкана выбираем главную цепь — самую длинную.
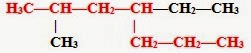
2. Затем эту цепь нумеруем с того конца, к которому ближе расположен заместитель (радикал). (Если заместителей несколько, то поступают так, чтобы цифры, указывающие их положение, были наименьшими) Заместители перечисляем по алфавиту.
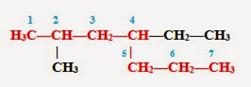
3. Называем углеводород: вначале указываем (цифрой) место расположения заместителя, затем называем этот заместитель (радикал), а в конце добавляем название главной (самой длинной) цепи.
Таким образом, углеводород может быть назван: 2-метил-4-этилгептан (но не 6-метил-4-этилгептан).
4. Свою номенклатуру имеют радикалы (углеводородные радикалы):
| Алкан - ан СnH2n+2 | Радикал (R) - ил СnH2n+1 | ||
| ФОРМУЛА | НАЗВАНИЕ | ФОРМУЛА | НАЗВАНИЕ |
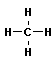 | метан | 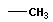 | метил |
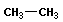 | этан | 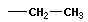 | этил |
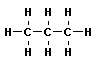 | пропан | 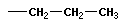 | пропил |
 | изопропил (втор -пропил) | ||
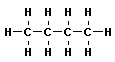 | бутан | 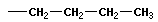 | н - бутил |
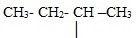 | втор -бутил | ||
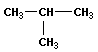 | изобутан (2 – метилпропан) | 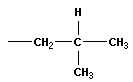 | изобутил (перв -изобутил) |
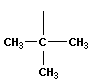 | трет -бутил | ||
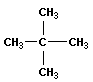 | неопентан (2,2-диметилпропан) | 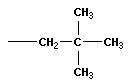 | нео -пентил |
5. Число одинаковых заместителей указывают при помощи множительных приставок:
два – «ди»
три – «три»
четыре – «тетра»
пять – «пента»
шесть – «гекса»
семь – «гепта»
восемь – «окта»
девять – «нано».
В обычных условиях: С1- С4 – газы, С5- С15 – жидкие, С16 – твёрдые. Температуры плавления и кипения алканов, их плотности увеличиваются в гомологическом ряду с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями.
Химические свойства алканов
Реакции замещения.
А) Галогенирование
при действии света - hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов)
В реакции образуются вещества галогеналканы RГ или Сn H2n+1Г
(Г - это галогены F, Cl, Br, I)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия);
метан хлорметан
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия);
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
тетрахлорметан
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
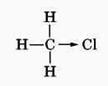
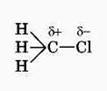
Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе (- СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
CH3 – CH2 – Cl + Cl2 hν → CH3 – CHCl2 + HCl
хлорэтан 1,1 -дихлорэтан
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Иодирование происходит обратимо, поэтому требуется окислитель для удаления HI из рекции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается при T>400˚C.
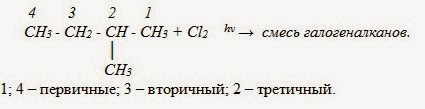
Б) Нитрование
(реакция М.И. Коновалова, он провёл её впервые в 1888 г)
CH4 + HNO3 (раствор) t˚С → CH3NO2 + H2O
нитрометан
RNO2 или Сn H2n+1 NO2 (нитроалкан)
 2017-11-01
2017-11-01 2058
2058