Основные правила IUPAC для алканов заключаются в следующем.
1. За основу названия берется самая длинная цепь углеродных атомов.
2. Основную цепь нумеруют арабскими цифрами так, чтобы цифры, указывающие положение боковых цепей, были наименьшими (2-метилпентан, а не 4-метилпентан):
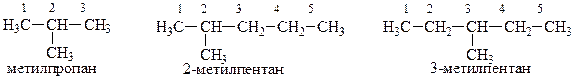
3. Если одна и та же алкильная группа встречается несколько раз, то перед ней ставят приставку ди-, три-, тетра- и т.д., чтобы указать число этих групп, и обозначают арабскими цифрами положение каждой группы:
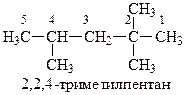
4. При наличии нескольких различных алкильных групп их перечисляют в порядке увеличения сложности или в алфавитном порядке
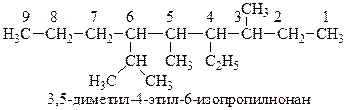
Способы получения алканов
Природными источниками алканов являются нефть и природный газ. Природный газ на 75 – 85% состоит из метана. Перегонка нефти позволяет получить смеси насыщенных углеводородов с различной длиной цепи (табл.1.2).
Таблица 1.2
| Фракция | Состав | Т кипения, °С |
| Природный газ | С1-С4 | Ниже 20 |
| Петролейный эфир | С5-С6 | 20-60 |
| Бензин | С4-С8 | 40-200 |
| Керосин | С10-С16 | 175-275 |
| Мазут (диз. топливо) | С15-С16 | 250-400 |
| Смазочные масла | С18-С22 | Выше 300 |
| Асфальт | Сложная смесь углеводородов (С20 и выше) | Нелетуч |
Методы получения алканов делятся на промышленные и лабораторные.
Промышленные методы
1. Метод Бергиуса (гидрогенизация бурых углей):
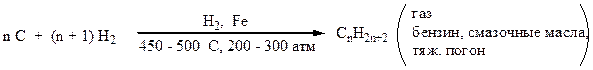
2. Метод Фишера-Тропша:
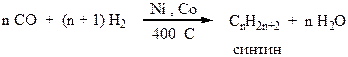
Синтин – смесь углеводородов.
В 1936 г. в Германии было налажено промышленное производство синтетических углеводородов. В 1941 г. по этому методу работало 9 заводов, а в 1942 г. объемы получения синтетического топлива составляли 740 тыс. т/год.
3. Крекинг нефти. Крекинг - это процесс расщепления углеводородов, т.е. образование углеводородов с меньшим числом углеродных атомов из углеводородов с большим числом углеродных атомов:
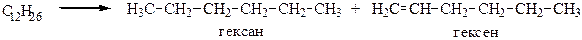
Существуют разновидности крекинга нефти – термический и каталитический.
1. Реакция Вюрца - это взаимодействие галогензамещенных алканов со щелочными металлами (K, Na, Li):
2 R-X + 2 Na ¾® R-R + 2 NaX
где X = Cl, Br, R - алкильный радикал (СН3-, СН3СН2-, (СН3)2СН- и др.)
Пример:
2 СН3СН2СН2Сl + 2 Na ¾® CH3(CH2)4CH3 + 2 NaCl
хлористый н-пропил н-гексан
2 СH3Br + 2 K ¾® CH3-CH3 + 2 KBr
бромистый метил этан
2 СН3СН2Сl + 2 Na ¾® CH3CH2CH2CH3 + 2 NaCl
хлористый этил н-бутан
Если в реакции Вюрца использовать в качестве исходных веществ различные галогенпроизводные, то образуется смесь трех различных углеводородов (алканов).
Пример:
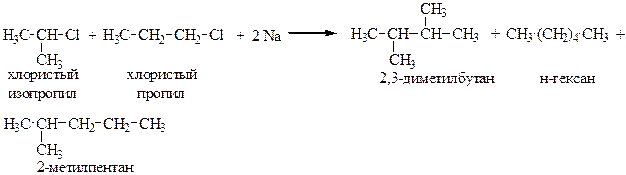
Недостатки способа: при взаимодействии различных по строению алкилгалогенидов образуется смесь углеводородов.
2. Реакция Кольбе - электролиз солей одноосновных карбоновых кислот:

Анод:
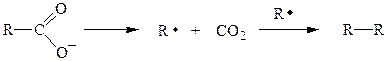
Пример:
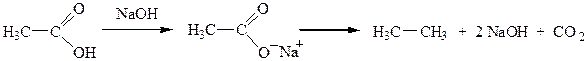
3. Декарбоксилирование солей карбоновых кислот:
300-400°C
СН3-СН2-COONa + NaOH ¾¾¾® CH3-CH3 + NaHCO3
4. Гидрирование алкенов:
Pd, Pt или Ni
СН3-СН=CH2 + H2 ¾¾¾¾¾® CH3-CH2-CH3
5. Восстановление галоидных алкилов:
[H]
CH3-CH2-CH2Br ¾® CH3-CH2-CH3 + HBr
6. Разложение реактивов Гриньяра соединениями, содержащими подвижный водород:
HOH
CH3-CH2Br + Mg ¾® CH3-CH2MgBr ¾¾® CH3-CH3 + MgOHBr
 2017-11-01
2017-11-01 860
860








