Физические свойства веществ зависят от их состава и строения.
Четыре первых члена гомологического ряда предельных углеводородов - вещества газообразные.
Начиная с пентана и выше нормальные углеводороды представляют собой жидкости, а с углеводорода С16Н34 высшие гомологи при обычной температуре - твердые вещества.
Температура кипения всех изоалканов ниже, чем нормальных алканов, причем тем ниже, чем более разветвлена цепь молекулы.
Относительная плотность алканов лежит в интервале 0,416 - 0,816 г/см3.
Парафины не растворимы в воде, в спирте же и эфире растворяются хорошо; с усложнением состава растворимость в спирте уменьшается.
Лекция №2. Строение и химические свойства алканов
Строение алканов. Состояние атома углерода. Модель молекулы метана. Конформации. Химические свойства алканов: реакции галогенирования, нитрования и др. Механизмы реакций. Окисление алканов. Крекинг и пиролиз. Отдельные представители.
Строение алканов
Углерод в насыщенных углеводородах находится в sp3 – гибридизованном состоянии. Для алканов характерны 2 вида s-связей – sС-Н и sС-С:
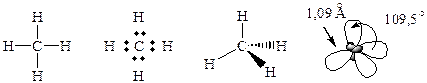
Как и любая ковалентная связь, связь в углеводородах характеризуется энергией, длиной, полярностью и направленностью. Угол и длина связей приведены на рисунке:
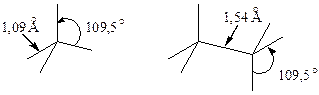
Энергия связи sС-Н составляет 413,7 кДж/моль (105 ккал/моль), а энергия sС-С - 350 кДж/моль (85 ккал/моль).
Нормальная цепь насыщенного углеводорода имеет вид
Свободное вращение атомов относительно связи С-С возможно благодаря форме орбитали. При вращении перекрывание орбиталей не нарушается.
Различные расположения атомов в молекуле алкана, которые могут взаимно превращаться друг в друга путем вращения вокруг С-С связи, называются конформациями. Энергия, необходимая для вращения, называется торсионной энергией (для этана – 3 ккал/моль или 12,56 Дж/моль).
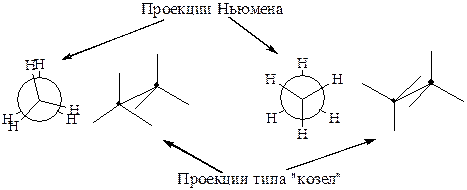
Благодаря возможности свободного вращения относительно связи С-С, для углеводородов существуют две конформации - заслоненная и заторможенная.
Для этана они изображаются следующим образом:
Заторможенные конформации бутана неодинаковы. Чтобы различить их между собой, конформер А называют анти-конформером, а конформеры Б и В – гош-конформерами:
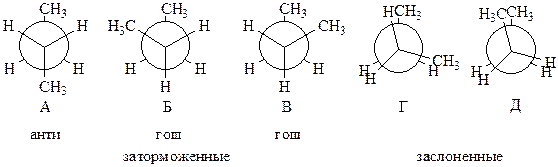
Так как молекула алкана неполярна, то между атомами существуют только Ван-дер-Ваальсовы силы взаимодействия. Электростатические силы притяжения между молекулами отсутствуют.
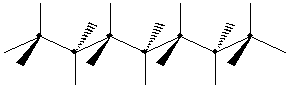
Конформации пентана:
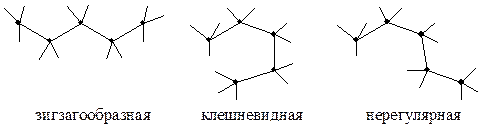
 2017-11-01
2017-11-01 1013
1013