Простейшая реакция взаимодействия метана с хлором приводит к образованию хлористого метила и хлористого водорода:
СН4 + Cl2 ¾® СН3Сl + НСl
Для того, чтобы определить практическое значение этой реакции, необходимо ответить на два вопроса:
о константах равновесия;
о скорости протекания данной реакции в данных условиях.
После того, как будет выяснено, что данная реакция должна протекать с удобной для нас скоростью, необходимо решить еще ряд практических вопросов: учесть побочные реакции, легкость выделения продуктов из реаакционной смеси и стоимость материалов, аппаратуры и труда, экологическую чистоту процесса.
Реакция метана и хлора - реакция равновесная:

Равновесие может быть описано следующим уравнением:
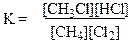
Величины, заключенные в квадратные скобки, означают либо концентрации (в случае жидких реагентов), либо парциальные давления для случая реагирующих газов. Если константа равновесия К больше единицы, то при смешении равных объемов реагентов (все они при температуре выше 24°С являются газами) реакция будет проходить слева направо. И наоборот, при значениях К меньше единицы равновесие реакции смещено в сторону исходных реагентов. Для случая хлорирования метана К больше единицы (данные эксперимента).
С точки зрения планирования других органических синтезов чрезвычайно важно было бы иметь возможность предсказывать величину К заранее.
Точное термодинамическое соотношение между константой равновесия реакции К, температурой реакции и энтальпией реакции выражается следующим уравнением:
-2,303 RT lgK = DН - TDS
где R - газовая постоянная, Т - абсолютная температура, К.
Зная значения DН и DS, можно вычислить и константу равновесия одной реакции. Из опыта известно, что К обычно больше единицы для большинства реакций с DН, имеющей более отрицательное значение, чем -15 ккал, и обычно меньше единицы при DН, имеющей более положительное значение, чем +15 ккал. Это положение используется в качестве «правила большого пальца» для предсказания величины константы К.
Скорость реакции
Как правило, химические реакции протекают в несколько стадий, и для того, чтобы верно определить скорость определяющей стадии реакции, необходимо знать механизм реакции.
Суммарный процесс взаимодействия метана с хлором описывается следующим брутто - уравнением:

На самом деле реакция проходит через ряд стадий (табл. 2.1).
Таблица 2.1
| Стадия | Реакция | Название стадий реакции |
| А | 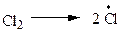 | инициирование цепи |
| Б | 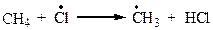 | рост цепи |
| В |  | |
| Г | 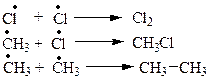 | обрыв цепи |
На каждой из стадий либо поглощается, либо выделяется энергия.
Стадия А: DН = +58 ккал/моль - тепло поглощается.
Стадия Б: DН = -1 ккал/моль - тепло выделяется.
Стадия В: DН = -23ккал/моль - тепло выделяется.
Стадия Г: DН = - 58 ккал/моль - тепло выделяется.
Суммарная энергия (теплота реакции) DНреакции = -24 ккал/моль.
Кравновесия = 1018.
В табл. 2.2 приведены теплоты реакции галогенирования по стадиям для F, Cl, Br, I.
Таблица 2.2
| Стадия | Реакция | Теплота реакции, ккал/моль | |||
| F | Cl | Br | I | ||
| А | 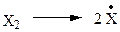 | +37 | +58 | +46 | +36 |
| Б |  | -33 | -1 | +15 | +31 |
| В | 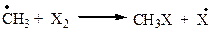 | -71 | -23 | -21 | -17 |
| Г | 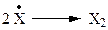 | -37 | -58 | -46 | -36 |
| DНсумм | -104 | -24 | -6 | +14 |
Легкость взаимодействия галогенов с метаном (а следовательно, и скорость реакции) убывает в следующем ряду: F > Cl > Br > I. Как видно из данных приведенной выше таблицы, относительные скорости согласуются с суммарными значениями DН всего процесса.
Энергетические профили для стадий роста цепи при хлорировании и бромировании имеют следующий вид:
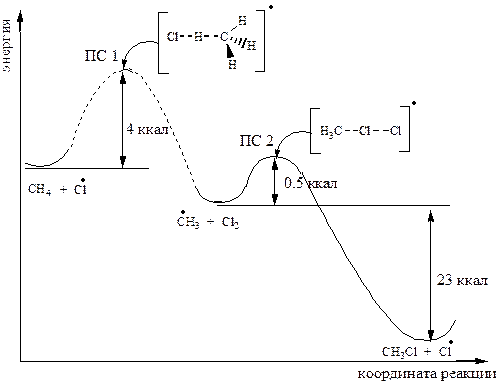
Переходное состояние (ПС) - максимум на энергетической диаграмме реакции. Группа атомов, участвующая в переходном состоянии, называется активированным комплексом.
В заключение можно сказать, что скорость галогенирования определяется скоростью первой стадии роста цепи, поскольку именно на этой стадии мы сталкиваемся с энергетическими барьерами (высокие значения Е), которые затрудняют бромирование и препятствуют иодированию.
2. Нитрование. Нитрование - реакция замещения атома водорода на нитрогруппу (NO2).
Нитрование может быть жидкофазным (М.И. Коновалов) и парофазным (Хесс, 1936-1937). В первом случае реакцию проводят с использованием 10 – 12% раствора азотной кислоты при 110 - 140°С, во втором случае температуру повышают до 350 - 400°С.
Общая схема реакции:
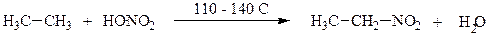
Свободнорадикальный механизм нитрования алканов:
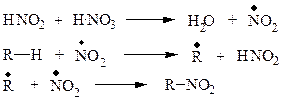
Состав продуктов нитрования, так же, как и в случае галогенирования, определяется относительной активностью различных С-Н связей.
Парофазное нитрование углеводородов, как, например, бутана, сопровождается расщеплением углеродной цепи:
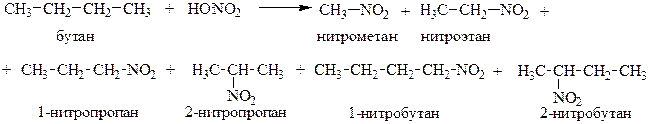
3. Сульфохлорирование. Сульфохлорирование алканов протекает по цепному радикальному механизму при УФ – облучении:

Механизм реакции:
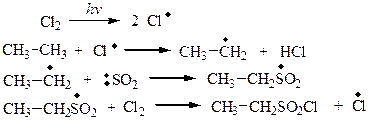
Обрыв цепи происходит при взаимодействии радикалов. Следует отметить, что третичный атом замещению на сульфохлоридную группу не подвергается, вероятно, из-за пространственных эффектов. Однако если в молекуле есть вторичные и первичные углеродные атомы, то замещение протекает в первую очередь у вторичного.
Реакции окисления
Углеводороды - источник энергии. При полном сгорании углеводородов в избытке кислорода образуются углекислый газ и вода, а также выделяется тепло (Q - теплота сгорания)
CnH2n+2 + изб. О2 ¾® n CO2 + (n + 1) H2O + Q
Пример:
С5Н12 + 8 О2 ¾® 5 СО2 + 6 Н2О + 845 ккал/моль
Q = 845 ккал/моль
Реакция полного окисления (сгорания) алканов используется в двигателях внутреннего сгорания, поэтому расчет теплового эффекта этого процесса весьма важен.
Теплота сгорания Q – это теплота реакции сгорания углеводорода. Для ее расчета необходимо знать теплоту образования исходных алканов.
Теплота образования
Теплотой образования (DНf) соединения называется изменение энтальпии, которое происходит при образовании 1 моля этого соединения из его составляющих. Это разница между энтальпией вещества и суммой энтальпий элементов, из которых оно состоит. Для этана теплота образования
DНf этана = Н этана - (2Н углерода + 3Н водорода),
т.е. молярная теплота образования этана = энтальпия 1 моль этана - (энтальпия 2 атомов углерода + энтальпия 3 моль газообразного водорода).
Для элементов в стандартном состоянии (комнатная температура и атмосферное давление) энтальпия равна нулю, тогда теплосодержание равно теплоте его образования. Теплота образования СН4 и NO2 приведена на рисунке:
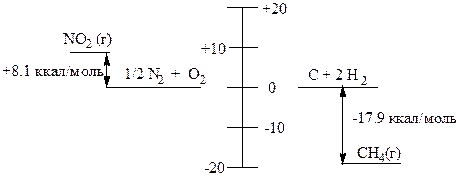
Теплота реакции
Теплота реакции равна изменению энтальпии (DН) в ходе реакции. В свою очередь изменение энтальпии, сопровождающее реакции, равно разности теплоты образования продуктов и теплоты образования исходных веществ.
Если DН - отрицательная величина, реакция экзотермическая (выделяется тепло); если DН - положительная величина, реакция эндотермическая (поглощается тепло).
DН = SDНf продуктов - SDНf исходных веществ
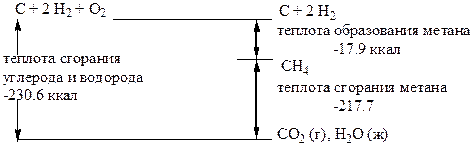
Качество моторного топлива (бензина) определяется его антидетонационными свойствами. Относительная антидетонационная способность топлива обычно характеризуется так называемым октановым числом. Чем выше октановое число, тем лучше бензин. Антидетонационные свойства зависят от строения углеводорода, т.е. от степени его разветвленности (табл. 2.3).
Таблица 2.3
| Октановое число | ||
| н-Гептан | Детонирует | |
| 2,2,4-триметилпентан | Не детонирует |
Разветвленные алканы и алкены, ароматические углеводороды обладают хорошими антидетонирующими свойствами. Их получают каталитическим крекингом, каталитическим риформингом. Сильно разветвленные алкены получают из алкенов и алканов реакцией алкилирования.
Бензиновую фракцию (бензин прямой перегонки) улучшают добавлением соединений с более высоким октановым числом.
Таким образом, проблему повышения октанового числа решают а) выбором соответствующего углеводорода; б) добавлением тетраэтилсвинца Pb(C2H5)4 - этилирование бензина (0,2 - 0,8 мг/л); в) созданием топлив с высоким октановым числом.
Мягкое окисление
Окисление высших парафинов проводят при температуре порядка 150°С в присутствии катализаторов, например соединений марганца. При этом получают смесь кислот с различной длиной цепи, оксикислоты, кетокислоты, сложные эфиры, спирты, кетоны и т.д. Важнейшим промышленным применением жидкофазного процесса окисления является производство уксусной кислоты из бутана (катализаторы - хром, кобальт, свинец):
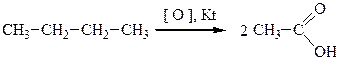
В процессе окисления предельных углеводородов в качестве промежуточных продуктов образуются органические гидроперекиси.
 2017-11-01
2017-11-01 1537
1537








