Горение может возникнуть в объѐме газо- или паро-воздушной смеси в результате еѐ воспламенения при нагревании в химическом реакторе, технологическом аппарате и т. п. В этом случае процесс горения возникает как бы самопроизвольно, поэтому его называют самовоспламенением.
Самовоспламенение –это явление резкого увеличения скоростиэкзотермических реакций окисления, приводящее к возникновению горения и/или взрыва.
В некоторых случаях горение может возникнуть за счѐт самонагревания, которое обусловлено происходящими в веществах физическими, химическими
и биологическими процессами при низких (до 70 С) температурах (окисление, разложение, адсорбция, конденсация, жизнедеятельность микроорганизмов и т. д.). Этот процесс называется самовозгоранием.
Причинами теплового самовозгорания веществ и материалов являются процессы адсорбции и окисления. Жизнедеятельность термофильных микроорганизмов служит причиной микробиологического самовозгорания. В основе химического самовозгорания лежит химическая реакция, протекающая с выделением большого количества тепла. К веществам, склонным к тепловому самовозгоранию, относятся также масла, жиры и олифы.
Условия самовозгорания зависят от химической природы материала, его формы и массы, начальных и граничных условий теплообмена с окружающей средой. При разработке мероприятий по предотвращению пожаров от самовозгорания необходимы знания параметров пожарной опасности веществ и материалов. К этим параметрам относятся температура самонагревания, температура тления и условия теплового самовозгорания.
Температура самонагревания –это температура,начиная с которой ввеществе или материале, находящемся в атмосфере воздуха, возникают практически различимые процессы окисления, разложения и т. п.
Температура самонагревания является самой низкой температурой вещества, нагревание при которой может потенциально привести к самовозгоранию. Безопасной температурой длительного нагрева вещества считается температура не выше 90 % от температуры самонагревания.

Различная способность растительных масел и животных жиров к самовозгоранию объясняется тем, что они содержат глицериды различного состава и строения и не в одинаковом количестве. Чем больше кислорода (йода) присоединяется к молекуле глицерида, тем больше тепла выделяется при окислении и, следовательно, тем больше способность глицеридов к самовозгоранию. О количестве глицеридов непредельных кислот в масле или жире судят по йодному числу масла, т. е. по количеству йода, поглощѐнному 100 г масла.
Температура самовоспламенения –наименьшая температура вещества,при которой в условиях специальных испытаний происходит резкое увеличение скорости экзотермических реакций, заканчивающихся пламенным горением.
Температура самовоспламенения Т свп, при стандартных условиях
различных веществ приведена в справочнике Баратова А. Н. «Пожаровзрывоопасность веществ и материалов и средства их тушения». Установлено, что в пределах гомологического ряда величина Т свп является функцией длины углеродной цепи в молекуле. Чем длиннее цепь, тем ниже температура самовоспламенения. Метод расчета Т свп основан на эмпирической зависимости Т свп от длины углеродной цепи.
Метод пригоден для расчета Т свп алифатических углеводородов, алифатических спиртов и ароматических углеводородов.
Задача состоит в том, чтобы по структурной формуле химического соединения найти для него среднюю длину углеродных цепей.
Углеродная цепь -это цепочка атомов углерода от одного концамолекулы до дрyгoгo.
Длина цепи -это число атомов углерода в такой цепи.
Например, в нормальном гептане
1 2 3 4 5 6 7
СН3 – СН2 - СН2 - СН2 - СН2 - СН2 - СН3 одна углеродная цепь и ее длина равна 7.
1 2 3
В изобутане СН3 – СН – СН3

СН3
три цепи с одинаковой длиной (цепь 1-2-3, 1-2-4 и 3-2-4), длина каждой цепи равна 3. Средняя длина углеродных цепей в этом соединении тоже равна 3.
Определив среднюю длину цепи, далее по приложениям 13-15 находят
Т свп.Например,для н -гептана Т свп=496К,а для изобутана Т свп=743К(приложение 13 для предельных углеводородов).
В молекуле химического соединения со сложной структурой иногда бывает трудно сразу найти все углеродные цепи. Поэтому для определения
числа цепей используют формулу
| m | M p(M p | 1) | , | (39) | |
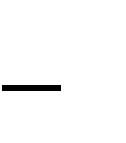
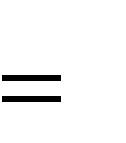
где М р-число концевых функциональных групп,таких как:-СН3,-ОН ибензольных колец.
Например, в н -гептане 2 группы СН3, т. е. М р= 2, из формулы (39) следует, что число цепей равно 1. В изобутане М р=3, подставляя это значение в формулу (39), получим m = 3.
2.3.1. РАСЧЁТ ТСВП ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ
ПРИМЕР: Вычислить температуру самовоспламенения 3-этил-4-изопропилгексана
Решение:
1. Записываем структурную формулу соединения, нумеруем все атомы
углерода:
1 2 3 4 5 6
СН3 – СН2 - СН2 - СН2 - СН2 – СН3


СН2

СН

– СН3
СН3
СН3
2. В молекуле соединения пять концевых метильных групп (СН3), т. е. М р=5. Определяем число цепей:

| m | M p(M p1) | 5(5 1) | |||
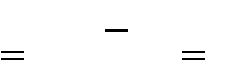

3. Найдем эти цепи и установим их длину. Для удобства составим следующую таблицу:
| Углеродная | 1 - 6 | 1 - 8 | 1 - 10 | 1 - 11 | 6 - 8 | 6 - 10 | 6 - 11 | 8 - 10 | 8 - 11 | 10 - 11 | |
| цепь m 1 | |||||||||||
| Длина цепи l 1 | |||||||||||
4. Определим среднее арифметическое значение длины углеродных цепей:


| 5,4. | |||||||
| l cp | |||||||
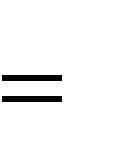
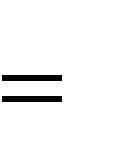
5. По таблице приложения 13 находим температуру самовоспламенения 3-этил-4-изопропилгексана, отыскивая еѐ по значению средней длины цепи в молекуле соединения:
Тсвп = 522 К или 249 оС.
2.3.2 ОСОБЕННОСТИ РАСЧЕТА ТСВП АЛИФАТИЧЕСКИХ СПИРТОВ
При определении длины углеродных цепей в молекуле алифатического спирта необходимо учитывать следующее правило: гидроксильная группа в углеродной цепи увеличивает еѐ длину на единицу.
ПРИМЕР: Вычислить температуру самовоспламенения 2,2-диметил-3-этилгексанола-1.
Решение:
1. Запишем структурную формулу соединения и пронумеруем все атомы углерода, группу ОН обозначим буквой Г (гидроксил).
СН2

| Г |
НО – СН2 - С – СН - СН2 – СН2 - СН3


8 9 10
СН3 СН2 – СН3
2. В молекуле 5 концевых групп: 4 метильных (-СН3) и одна гидроксильная (-ОН), т. е. М р = 5. Тогда число цепей:
| m | М р(М | р 1) | 5(5 1) | |||
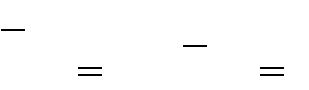

3. Составим таблицу, в которую внесем цепи и их длину:
| Углерод- | |||||||||||
| ная цепь | Г - 6 | Г - 7 | Г - 8 | Г - 10 | 7 - 6 | 7 - 8 | 7 - 10 | 6 - 8 | 6 - 10 | 8 - 10 | |
| m 1 | |||||||||||
| Длина | |||||||||||
| цепи l 1 | |||||||||||
Длина первых четырех цепей, содержащих гидроксильную группу (-ОН) на единицу больше, чем число атомов углерода в цепи.
4. Рассчитываем среднюю длину углеродных цепей:


| 5,2. | ||||||||||
| l ср | ||||||||||


5. По таблице приложения 14 находим соответствующую температуру самовоспламенения Т свп = 582 К или 309 оС.
2.3.3. ОСОБЕННОСТИ РАСЧЕТА ТСВП АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
При определении числа цепей и их длины в молекуле ароматического соединения следует иметь в виду следующие правила:

фенил (бензольное кольцо), находящийся внутри углеродной цепи, считается и как концевой;

при определении углеродной цепи атомы углерода в бензольном кольце в
расчет не принимаются;

фенил, находящийся в углеродной цепи, укорачивает еѐ на единицу.
ПРИМЕР: Вычислить температуру самовоспламенения 1-изопропил-4-изобутилбензола.
Решение:
1. Записываем структурную формулу соединения и вводим обозначения:
СН3

1 2 Ф 4 5
СН3 – СН -  –СН2 – СН
–СН2 – СН


3 7
СН3 СН3
2. В молекуле соединения 4 концевые метильные группы (-СН3) и 1 фенил, т. е. М р = 5:
| m | М р(М | р 1) | 5(5 1) | . | |||
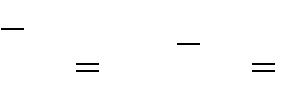

3. В этом соединении, согласно первому правилу, концевым необходимо считать и фенил. В этом случае углеродные цепи будут заканчиваться не только на метильных группах (-СН3), но и на бензольном кольце. Составим таблицу, в которую внесем углеродные цепи и их длину:
| Углеродная | 1 - 6 | 1 - 7 | 3 - 6 | 3 - 7 | 1 - Ф | 3 - Ф | 6 - Ф | 7 - Ф | 1 - 3 | 6 - 7 | |
| цепь m 1 | |||||||||||
| Длина цепи | |||||||||||
| l 1 | |||||||||||
Обратите внимание, что при определении длины цепи атомы углерода, имеющиеся в бензольном кольце, в расчет не принимаются (правило 2). У восьми углеродных цепей, которые имеют в своѐм составе фенил как в
середине, так и в конце цепи, длина цепи на единицу меньше, чем число атомов углерода (правило 3).
4. Рассчитаем среднюю длину углеродных цепей:

| 1 2 | . | ||||||||
| l ср | 2,8 | ||||||||


5. По таблице приложения 15 найдем Тсвп ароматического соединения с соответствующей длиной цепи Тсвп = 698 К или 425 оС.
ПРИМЕР: Вычислить температуру самовоспламенения2,2-дифенилпропана.
Решение:
1. Записываем структурную формулу соединения и вводим обозначения
СН3

Ф1 2 Ф2

 - С –
- С –

СН3
2. Определим число цепей. В соединении 4 концевых группы (2 метильные и 2 фенила), поэтому Мр = 4:
| m | М р(М | р 1) | 4 (4 1) | 6. | ||

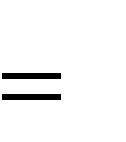
В этом соединении 6 цепей.
3. Найдем эти цепи и определим их длину:
| Углеродная цепь m 1 | Ф1 – Ф2 | Ф1 - 1 | Ф1 - 3 | Ф2 - 1 | Ф2 - 3 | 1 - 3 |
| Длина цепи l 1 | -1 | |||||
Цепи, содержащие фенил, укорачиваются на единицу. Так как в цепи Ф1 - Ф2 содержится два фенила, то еѐ длина уменьшится на 2.
4. Средняя длина цепи:

1 1 4 3

l ср 16 1.
5. По таблице приложения 15 находим, что Тсвп = 712 К или 439 оС.
 2017-10-25
2017-10-25 4797
4797
