По аппроксимационной формуле можно рассчитать значения и нижнего,
и верхнего концентрационных пределов распространения пламени для стандартных условий, т. е. при температуре 25 оС или 298 К, %:
| КПРП | , | (41) | ||||
| (а | ||||||
| b) |

где  - стехиометрический коэффициент при кислороде (число молей кислорода, необходимое для полного сгорания 1 моля горючего вещества, определяемое по уравнению реакции горения);
- стехиометрический коэффициент при кислороде (число молей кислорода, необходимое для полного сгорания 1 моля горючего вещества, определяемое по уравнению реакции горения);
a, b –константы,имеющие определѐнные значения для НКПРП и ВКПРП взависимости от значения, приведѐнные в таблице 20.

| Таблица 20 | ||||
| Предел распространения | a | b | ||
| пламени | ||||
| Нижний | 8,684 | 4,679 | ||
| Верхний при | ≤ 7,5 | 1,550 | 0,560 | |
| Верхний при | > 7,5 | 0,768 | 6,554 |

При температурах, отличных от 298 К (25 оС), КПРП рассчитываются по формулам, %
| н Т | н | 298 (1 | Т | ), | (42) | |||||
| в Т | в | 298 (1 | Т | ), | (43) | |||||




Для перевода значения КПРП из объѐмных единиц в весовые (кг/м3) можно воспользоваться формулой


| / | КПРП | КПРП | М | , | (44) | |
| Vt 100 | ||||||


где М – молярная масса вещества, кг/кмоль;
Vt –молярный объѐм парогазовоздушной смеси при стандартных(Т= 298Ки Р = 101,3 кПа) Vt = 24,5 м3/кмоль.
ПРИМЕР: Рассчитать КПРП метана в воздухе(в%и кг/м3)при температуре17оС и давлении 100 кПа., пользуясь аппроксимационной формулой.
Решение:
1. Для того чтобы определить число молей кислорода, идущее на полное сгорание 1м3 метана, записывается уравнение горения метана в воздухе:
СН4 + 2 (О2 + 3,76 N2) = СО2 + 2Н2О + 2 · 3,76 N2.

Из уравнения видно, что = 2
2. По аппроксимационной формуле рассчитываются значения н и в, воспользовавшись значениями a и b, взятыми из табл.20. При расчете



ВКПРП учитываем, что = 2 < 7,5:
| н | 4,5% | ; | |||||
| (а | b) 8,684 2 4,679 | ||||||
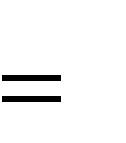
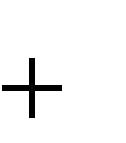


| в | 27,3%. | |||||
| (а | b) 1,55 2 0,56 | |||||
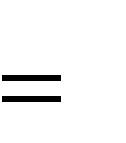
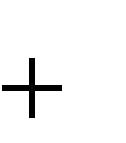


3. По формулам (42 и 43) пересчитываем значения КПРП при температуре
17+273 = 290 К:
| н Т | н | 298 (1 | Т | ) | 4,6 (1 | 290 298 | ) 4,63 %; | ||||||||
| в Т | в | 298 (1 | Т | ) | 27,3 (1 | 290 298 | ) 27,03 %. | ||||||||










4. Рассчитывается молярная масса вещества:
М = 12 + 4 1 = 16 (кг/кмоль).
5. Согласно объединѐнному газовому закону, рассчитывается молярный объѐм при температуре 17 оС или 290 К:

| V | Р 0 V 0 Т | 101,3 22,4 290 | 24,1 м3/кмоль. | ||
| t | РТ 0 | 100 273 | |||






6. Рассчитываются КПРП по формуле:


| / | н | н М | 4,63 16 | 0,03 | кг/м | ||||||||||||
| Vt | 24,1 100 | ||||||||||||||||
| / | в | в | М | 27,03 16 | 0,18 кг/м | . | |||||||||||
| Vt | 24,1 100 | ||||||||||||||||


Ответ: КПРП природного газа при17оС составляют4,63 – 27,03 %или0,03 – 0,18 кг/м3.
ПРИМЕР: Рассчитать, какое минимальное количество изоамилацетата должно испариться в ѐмкости объѐмом 200 м3, чтобы в ней создалась минимальная взрывоопасная концентрация его паров. НКПРП рассчитать по предельной теплоте сгорания.
Решение:
1. Составляем уравнение реакции горения изоамилацетата в воздухе:
С7Н14О2 + 9,5 (О2 + 3,76 N2) = 7 СО2 +7 Н2О + 9,5 3,76 N2.
2. Минимальная взрывоопасная концентрация это есть величина нижнего концентрационного предела распространения пламени, т.е. нам необходимо найти НКПРП, пользуясь аппроксимационной формулой:
| н | 1,2 % | |||||
| (а | b) 8,684 9,5 4,679 | |||||
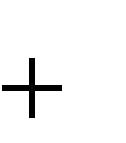


3. Пересчитаем НКПРП из % в кг/м3, учитывая, что молярный объѐм при стандартных условиях равен 24,45 м3/кмоль:


| / | н | н | М | 1,2 130 | 0,064 | кг/м | ||||
| Vt | 24,45 100 | |||||||||




4. Рассчитываем количество испарившегося изоамилацетата:
m  / н
/ н

 V пом
V пом
0,064  200
200 
12,8
кг
Ответ:
для образования в ѐмкости взрывоопасной концентрации
объѐмом 200 изоамилацетата
м3
в
минимальной ней должно
испариться 12,8 кг вещества.
 2017-10-25
2017-10-25 869
869








