Перегонка (объединяющая дистилляцию и ректификацию)- процесс, включающий частичное испарение разделяемой смеси и последующую конденсацию образующихся паров, осуществляемое однократно или многократно.
Разделение перегонкой основано на различной летучести компонентов смеси при одной и той же температуре.
Будем рассматривать бинарные смеси.
Компонент, упругость пара которого выше, а температура кипения ниже, является летучим и называется низкокипящим компонентом- НК. А компонент с упругостью пара ниже, а температурой кипения выше называется труднолетучим или высококипящим – ВК.
Пример: 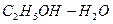
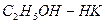 -
- 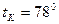
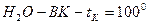
Жидкость, которая осталась после частичного испарения, называется остаток, а жидкость, которая получилась при конденсации пара, называется дистиллятом.
Существует два принципиально отличных вида перегонки:
1.Простая перегонка (или дистилляция)- процесс однократного частичного испарения жидкой смеси и конденсации образующихся паров; применима только для разделения смесей, летучести компонентов, которой существенно разделены. Обычно используют для предварительного разделения смесей.
2.Ректификация- процесс разделения гомогенных смесей путем многократного ступенчатого или непрерывного тепломассообмена между неравновесными встречными потоками пара и жидкости, это процесс многократного частичного испарения жидкости и испарения паров.
Разделение обычно осуществляется в колонных аппаратах при многократном и непрерывном контакте фаз, сопровождающемся испарением НК и конденсацией ВК. При конденсации паров, отходящих из верхней части колонны образуется дистиллят (ректификат), часть которого в виде флегмы возвращается для орошения верхней части колонны. В нижней части колонны удаляется кубовый остаток – продукт, обогащенный ВК.
Классификация бинарных систем.
Бинарные смеси подразделяются на:
1. Смеси с неограниченной взаимной растворимостью:
а) идеальные (подчиняются закону Рауля)
б) неидеальные - реальные-(с положительным и отрицательным отклонением от закона Рауля)
2. Смеси взаимно нерастворимые.
3.Ограниченно растворимые друг в друге.
Бинарные смеси, неограниченно растворимые друг в друге:
а) Идеальные смеси
вспомним правило фаз: С=К+2-Ф, где
К – число компонентов, в нашем случае К=2 (бинарная система).
Ф – число фаз- если между компонентами не происходит химического взаимодействия, то при наличии пара и жидкости, число фаз = 2, тогда число степеней свободы С=2+2-2=2. Это означает, что из тех независимых параметров, полностью описывающих состояние системы - температура, давление, концентрация- 2 параметра изменяются, а один параметр неизменен. Т.е. можно произвольно выбрать любые два, при этом определяется значение третьего.
Поэтому бинарные смеси представляют в виде фазовых диаграмм:
1. При t=const диаграмма давление- состав жидкости Р - х.
P=f(x)
2. При Р=const диаграмма температура состав жидкости, состав пара t –x,y
t=f(x,y)
3.При Р=const диаграмма равновесия y-x
y=f(x)
Идеальные смеси подчиняются закону Рауля: при постоянной температуре парциальное давление компонента (А) в паре (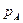 ) прямопропорционально мольной доле
) прямопропорционально мольной доле 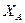 этого компонента в жидкости. При этом коэффициент пропорциональности равен давлению насыщенного пара
этого компонента в жидкости. При этом коэффициент пропорциональности равен давлению насыщенного пара 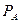 данного компонента при данной температуре.
данного компонента при данной температуре.
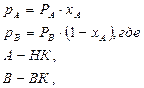
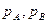 - парциальное давление А и В
- парциальное давление А и В
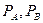 - упругость пара компонентов А и В (по таблице)
- упругость пара компонентов А и В (по таблице)
x,y- мольные доли
Запишите: Расчет ректификации ведется по НК компоненту и в мольных долях (в отличии от абсорбции, где концентрация в кмоль на кмоль)
x – содержание НК в жидкости
y- Содержание ВК в паре
Одновременно, согласно закону Дальтона: общее давление пара над раствором Р равно сумме парциальных давлений его компонентов:
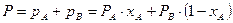 т.е. парциальные давления компонентов изменяются по линейным законам и обладают свойством аддитивности и при постоянной температуре парциальные давления компонентов, а также общее давление паров над смесью находится в линейной зависимости от мольной доли
т.е. парциальные давления компонентов изменяются по линейным законам и обладают свойством аддитивности и при постоянной температуре парциальные давления компонентов, а также общее давление паров над смесью находится в линейной зависимости от мольной доли 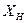 низкокипящего компонента.
низкокипящего компонента.
Эти уравнения можно выразить графически на Р-х диаграмме, на которой по оси абсцисс отложен состав жидкости х, а по оси ординат – давление пара Р. Уравнения изображаются прямыми линиями: парциальное давление НК- линией СВ, парциальное давление ВК- линией АD, полное общее давление – линией АВ. Отрезок DB равен упругости пара чистого НК, а АС- упругости пара чистого ВК. Описанное построение относится к некоторой постоянной температуре, следовательно, линии АD, СВ и АВ являются изотермами.
1.Строим диаграмму давление- состав жидкости Р-х при t=const.
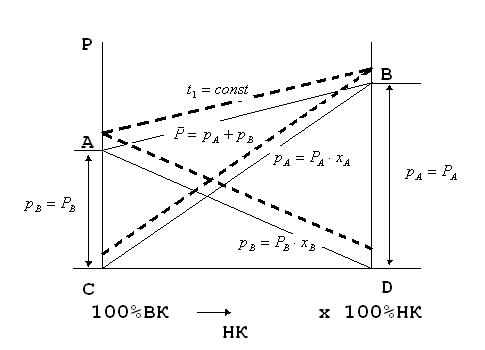
DB и CA- упругость паров компонента А и В
При 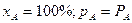
При 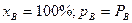
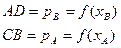
АВ – общее давление Р.
Пользуясь диаграммой Р-х можно определить температуру кипения смеси различного состава.
Строят по значениям из справочников. Для этого надо построить ряд изотерм полного давления, соответствующих температурам 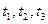 . Далее проводят горизонтальную линию MN с ординатой, равной внешнему давлению.
. Далее проводят горизонтальную линию MN с ординатой, равной внешнему давлению.
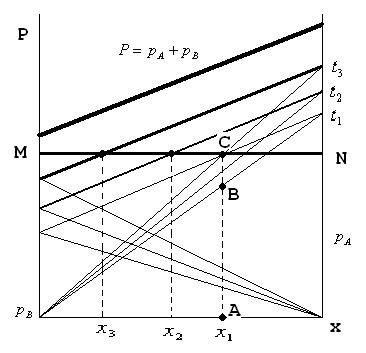
MN-линия внешнего давдения
Из точки на оси абсцисс, отвечающей х, восстанавливают перпендикуляр до пересечения с MNв т.С, через которую проходит изотерма 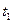 =const. При этой температуре общее давление пара смеси равно внешнему давлению, и следовательно, смесь состава х, кипит при температуре
=const. При этой температуре общее давление пара смеси равно внешнему давлению, и следовательно, смесь состава х, кипит при температуре 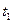 . Аналогично
. Аналогично 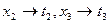 . При температуре кипения
. При температуре кипения 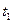 смеси
смеси 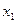 отрезок АВ – это парциальное давление НК -
отрезок АВ – это парциальное давление НК - 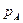 и ВС- парциальное давление ВК-
и ВС- парциальное давление ВК- 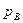 .
.
Определив температуры кипения и составы паров для смесей разного состава, можно построить t-x,y, и y-x диаграммы.
2. Диаграмма t-x,y (температура – состав жидкости – состав пара) при Р=const.
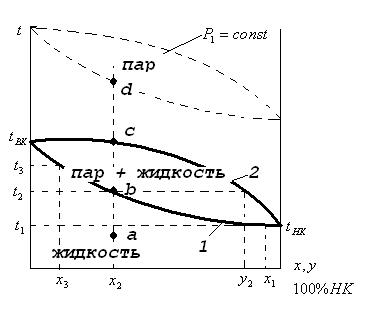
Построение этой диаграммы ведется на основании диаграммы давление – состав жидкости. Наносятся точки t кипения НК и ВК компонентов, жидкости смеси состава 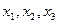 , затем точки с координатами
, затем точки с координатами 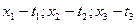 и соединяются кривой. Нижняя кривая – это температура кипения жидкой смеси.
и соединяются кривой. Нижняя кривая – это температура кипения жидкой смеси.
Надо построить линию пара.
Далее откладываем по оси абсцисс составы паров 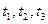 и соединяя точки получаем линию, называемую линией конденсации.
и соединяя точки получаем линию, называемую линией конденсации.
В соответствии с законом Дальтона парциальное давление 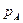 данного компонента А пропорционально его мольной доле
данного компонента А пропорционально его мольной доле 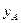 в паре
в паре 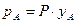 , а так как
, а так как 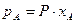 по закону Рауля, то зависимость между составами равновесных фаз
по закону Рауля, то зависимость между составами равновесных фаз 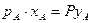 отсюда
отсюда 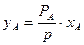 . Зная х, общее давление и давление насыщенного пара над чистой жидкостью, найдем
. Зная х, общее давление и давление насыщенного пара над чистой жидкостью, найдем 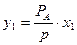 , по
, по 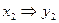 .
.
Получим точки: 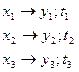
По этим координатам строим вторую кривую- линию конденсации.
1-линия кипения
2-линия конденсации
Точки:
а- чистая жидкость состава 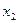
b - t кипения жидкости 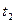 состава
состава 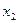
с – температура пара состава 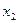
d- Перегретый пар
Что бы найти состав пара для какой – либо смеси, надо отложить на оси абсцисс состав этой смеси и из этой точки провести вертикаль до пересечения с линией кипения. Далее провести горизонталь до х с линией конденсации. Абсцисса последней точки пересечения выражает искомый состав пара.
3.Строим диаграмму равновесия y-x (состав пара – состав жидкости).
На фазовой диаграмме y-x наносится линия равновесия, выражающая в данном случае зависимость между равновесными составами (по НК) жидкой (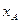 ) и паровой (
) и паровой (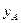 ) фаз.
) фаз.
Вершины х=0
х=1
Диаграмма строится при Р=const, т.е. для переменных температур кипения, изменяющихся в зависимости от изменения жидкой смеси. В выражение для 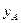 подставим значение общего давления из закона Дальтона и получим
подставим значение общего давления из закона Дальтона и получим 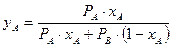 . Разделим числитель и знаменатель на
. Разделим числитель и знаменатель на 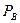 и введем понятие относительной летучести
и введем понятие относительной летучести 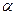 компонентов смеси
компонентов смеси 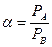 . Тогда
. Тогда
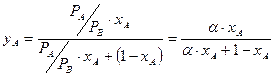
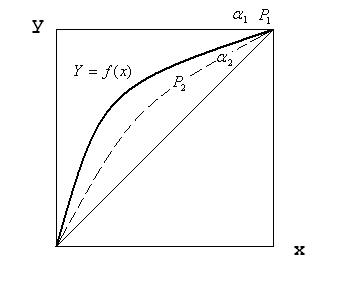
Это уравнение параболы. Крайние точки кривой равновесия расположены в противоположных углах квадрата. В реальном случае эта кривая не парабола и имеет другую форму.
В практических расчетах, зная давление паров чистых компонентов определяют относительную летучесть 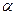 , а далее уже можно построить кривую равновесия для идеальных смесей. Чем больше
, а далее уже можно построить кривую равновесия для идеальных смесей. Чем больше 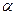 , тем более выпуклая кривая равновесия, тем легче разделить смесь.
, тем более выпуклая кривая равновесия, тем легче разделить смесь. 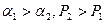 .
.
 2017-11-01
2017-11-01 6883
6883







