Стехиометрия — раздел химии, занимающийся изучением количественного состава, количественного соотношения химических элементов в веществах и веществ в химических реакциях.
Стехиометрические исследования позволяют установить химическую формулу вещества и составить химическое уравнение реакции. Уравнение химической реакции, как правило, не показывает ее механизма, т.е. реальной последовательности превращений атомов и молекул в химическом процессе, а только отражает закон сохранения массы (точнее, числа атомов элементов).
Основой для стехиометрических расчетов по химическим формулам и уравнениям являются атомная и молекулярная массы. О тносительной атомной массой элемента (атомной массой), Аr, называют отношение средней массы атома при его природном изотопном составе к 1/12 массы атома изотопа углерода 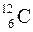 . Аналогично о тносительной молекулярной массой вещества (молекулярной массой), Мr, называют отношение средней массы вещества определенного формульного состава, включающего атомы отдельных элементов в их природном изотопном составе, к 1/12 массы атома изотопа углерода
. Аналогично о тносительной молекулярной массой вещества (молекулярной массой), Мr, называют отношение средней массы вещества определенного формульного состава, включающего атомы отдельных элементов в их природном изотопном составе, к 1/12 массы атома изотопа углерода 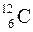 . Аr и Мr – безразмерные величины, которые определяется в атомных единицах массы. Атомная единица массы (а.е.м.) равна 1/12 массы атома изотопа углерода 12С. В системе СИ ее значение составляет (1,6605655±0,0000086)∙10–27 кг.
. Аr и Мr – безразмерные величины, которые определяется в атомных единицах массы. Атомная единица массы (а.е.м.) равна 1/12 массы атома изотопа углерода 12С. В системе СИ ее значение составляет (1,6605655±0,0000086)∙10–27 кг.
|
|
|
Наряду с массой в химических расчетах часто используется количество вещества, n. Количество вещества – физическая величина, введенная для количественной оценки структурных элементов вещества. Структурными элементами могут быть атомы, молекулы, ионы, радикалы, электроны и другие частицы или группы частиц. Единицей количества вещества является моль. Моль – количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в изотопе углерода-12 (12С) массой 0,012 кг (точно). Один моль любого вещества содержит число Авогадро (NA = 6,022×1023) структурных единиц вещества.
Молярная масса, М, – масса одного моля вещества. Рассчитывается через массу (m) и количество вещества (n) по формуле: М = m / n. Единицей молярной массы в СИ является кг/моль, но в химии обычно используют г/моль. Молярная масса, М, вещества (в г/моль) численно равна его относительной молекулярной (атомной) массе, Мr (Аr).
Для расчетов количеств участников реакции удобно использовать такое понятие как эквивалент вещества. В этом случае в основе расчетов лежит закон эквивалентов:
Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам: nэкв(А) = nэкв(В).
Эквивалент, Э (X), – это реальная или условная частица вещества, (X), которая может присоединять, замещать, высвобождать один ион водорода в кислотно-основных реакциях; или быть эквивалентна одному электрону в окислительно-восстановительных реакциях, или – единице заряда в обменных реакциях между солями.
|
|
|
Эквивалент – безразмерная величина, состав которой выражается с помощью химических формул и символов. При определении эквивалента вещества необходимо исходить из конкретной реакции, в которой участвует данное вещество.
Фактор эквивалентности, f экв(X), – число, обозначающее, какая доля реальной частицы вещества эквивалентна одному иону водорода, или одному электрону, или единице заряда. Фактор эквивалентности рассчитывается следующим образом: f экв(X) = 1/ z, где z – эквивалентное число. Эквивалентное число определяется на основании стехиометрии реакции.
Рассмотрим несколько примеров определения формулы эквивалента вещества.
В окислительно-восстановительной реакции (2.1)
Zn + 2НCl = ZnCl2 + Н2 (2.1)
участвуют два электрона.
Zn + 2Н+ + 2 е = Zn2+ + Н2.
Тогда на один электрон приходится
1/2Zn + НCl = 1/2ZnCl2 + 1/2Н2,
т.е. одному электрону соответствует 1/2 атома Zn, одна молекула НCl, 1/2 молекулы ZnCl2 и 1/2 молекулы Н2.
Отсюда Э (Zn) = 1/2 Zn, f экв(Zn) = 1/2; Э (НCl) = НCl, f экв(НCl) = 1; Э (ZnCl2) = 1/2ZnCl2, f экв(Zn Cl2) = 1/2; Э (Н2) = 1/2Н2, f экв(Н2) = 1/2.
Для кислотно-основной реакции (2.2)
Н2SО4 + 2NaОН = Na2SО4 + 2Н2О (2.2)
на один ион водорода приходится
1/2Н2SО4 + NaОН = 1/2Na2SО4 + Н2О.
Поэтому Э (Н2SО4) = 1/2Н2SО4, f экв(Н2SО4) = 1/2; Э (NaOH) = NaOH, f экв(NaOH) = 1, Э (Na2SО4) = 1/2Na2SО4, f экв(Na2SО4) = 1/2; Э (Н2О) = Н2О, f экв(Н2О) = 1.
В обменной реакции (2.3)
Al2(SO4)3 + 3BaCl2 = 2AlCl3 + 3BaSO4, (2.3)
происходящей с участием 6 единиц заряда, на одну единицу заряда приходится
1/6Al2(SO4)3 + 1/2BaCl2 = 1/3AlCl3 + 1/2BaSO4.
Следовательно, Э (Al2(SO4)3) = 1/6Al2(SO4)3, f экв(Al2(SO4)3) = 1/6; Э (AlCl3) = 1/3AlCl3, f экв(AlCl3) = 1/3; Э (BaCl2) = ½BaCl2, f экв(BaCl2) = ½; Э (BaSO4) = ½BaSO4, f экв(BaSO4) = ½.
Молярной массой эквивалента вещества, М (1/ zX), называют массу одного моля эквивалента этого вещества, которая определяется как произведение молярной массы вещества, М (X), на фактор эквивалентности: М (1/ zX) = (1/ z) М (X). Единица измерения – г/моль.
Для рассмотренных реакций М (1/2Zn) = 1/2 М (Zn), М (NaOH) = М (NaOH), М (1/6 Al2(SO4)3) = 1/6 М (Al2(SO4)3).
Смысл введения понятия эквивалент состоит в том, что, по определению, в реакции участвует равное число эквивалентов кислоты и основания, окислителя и восстановителя и т.д. Отсюда следует, что эквиваленты всех веществ реагируют друг с другом в отношении 1:1 без остатка.
Молярный объем, Vn, – объем одного моля вещества (или отношение объема, занимаемого веществом к его количеству). Единицей молярного объема в СИ является м3/моль, но в химии обычно используют л/моль.
Согласно закону Авогадро одно и то же число молекул любого газа занимает при одинаковых условиях один и тот же объем. Следовательно, при определенных температуре и давлении 1 моль любого газа занимает один и тот же объем. При нормальных условиях (273 К и 101,325 кПа) он составляет 22,4 л (Vn = 22,4 л/моль). Молярные объемы твердых и жидких веществ в отличие от газообразных специфичны для каждого вещества.
 2017-11-01
2017-11-01 838
838







