Расчетные формулы определения массы вещества m(А) для разных приемов и способов титрования, при различных способах выражения концентрации рабочего раствора, приведены в таблице 1.3. Прежде чем приступать к вычислениям, следует представить уравнения протекающих реакций, определить прием и способ титрования, а также, с учетом протекающих реакций, найти молярную массу эквивалента определяемого вещества. Приведенные формулы легко дополняются необходимыми множителями для вычисления содержания компонента А в анализируемой пробе.
пробе.
Например, от массы определяемого компонента m(А) можно перейти к его массовой доле w(А) (%) через отношение m(А) к массе навески mа: w(А) = m(А)·100/mа.
Пример 5. Определить массу железной проволоки, которую растворили в серной кислоте, а на титрование полученного раствора израсходовали 40,00 мл рабочего раствора KMnО4 c T (KMnO4/Fe2+) = 0,005585 г/мл.
Р е ш е н и е. Титрование прямое, способ – отдельных навесок.
Fe + Н2SO4 = FeSO4 + Н2↑ (растворение),
2KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + К2SO4 + 8H2О,
m (Fe) = m (Fe2+) = T (KMnO4/Fe2+)· V (KMnO4) = 0,005585•40,00 = 0,2230 г.
Пример 6. Навеска кальцинированной соды массой 0,1267 г растворена в воде и оттитрована в присутствии индикатора метилового оранжевого 22,65 мл 0,1002 н. раствора HCl. Вычислить массовую долю Na2CO3 в образце.
Р е ш е н и е. Проведено прямое титрование по реакции
Na2CO3 + 2HCl = H2CO3 + 2NaCl.
Индикатор метиловый оранжевый имеет переход окраски в кислой среде, что указывает на оттитровывание не одного, а двух эквивалентов Na2CO3.
М (1/2 Na2CO3) = 1/2 M (Na2CO3) = 105,99/2 = 52,99 г/моль;
w (Na2CO3) = •  ;
;
w (Na2CO3) =  =94,92%.
=94,92%.
Пример 7. Навеску 3,017 г пестицида, содержащего 20,86% формальдегида обработали 50,00 мл 1,0 М (k = 0,9022) раствора NaOH в присутствии пероксида водорода:
HCOH + OH– + H2O2 = HCOO– + 2H2O.
Избыток щелочи оттитровали раствором HCl c T (HCl) = 0,03798 г/мл. Какой объем HCl израсходован на титрование?
Р е ш е н и е. В данном примере использован прием обратного титрования по способу отдельных навесок. Учитывая условие задачи, найдем массу HCOH в навеске пестицида:
m (HCOH) = mнав.• w (HCOH) = 3,017 •20,86/100 = 0,6293 г.
Поскольку содержание HCOH определялось обратным титрованием, то согласно табл. 1.3 справедливо:
m (HCOH) = 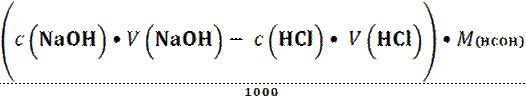 ;
;
f экв.(HCOH) = 1; M (HCOH) = 30,01 г/моль;
с (HCl) =  =
= 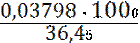 = 1,0420 моль/л;
= 1,0420 моль/л;
с (NaOH) = K•стеор. (NaOH) = 0,9022•1,0 = 0,9022 моль/л.
Преобразуем выражение для расчета m(HCOH) относительно V(HCl):
V (HCl) =  -
-  ,
,
V (HCl) =  -
-  = 43,29 – 20,12 = 23,17 мл.
= 43,29 – 20,12 = 23,17 мл.
Пример 8. 1,1622 г поваренной соли растворили в воде и раствор разбавили до 200,0 мл. К 20,00 мл этого раствора прибавили 25,00 мл 0,1000 н. раствора AgNO3. На титрование избытка AgNO3 израсходовали 5,080 мл 0,0900 н. раствора NH4SCN. Определить массовую долю хлорида натрия в образце соли.
Р е ш е н и е. Проведено обратное титрование способом аликвот. Для расчета используем (табл. 1.3) уравнение:
w (NaCl) = 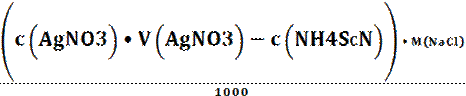 •
•  •/
•/
В соответствии с уравнением реакции:
fэкв. (NaCl) = 1, M (NaCl) = 58,44 г/моль.
w (NaCl) =  •
• 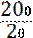 •
•  = 99,46 %.
= 99,46 %.
Пример 9. Из 25,00 мл раствора свинец осадили в виде PbCrO4, осадок отфильтровали, растворили в кислоте и добавили избыток KI. На титрование выделившегося иода израсходовали 31,50 мл 0,1010 н. раствора Na2S2O3. Рассчитайте количество свинца в растворе (г) и молярную концентрацию ионов свинца в исходном растворе.
Р е ш е н и е. В данном примере проведено определение ионов Pb2+ приемом титрования заместителя согласно реакциям:
Pb2+ + CrO42- = PbCrO4↓ (осаждение);
2PbCrO4↓ +2H+ = Cr2O72– + 2Pb2+ + H2O (растворение);
Cr2O72– + 6I– + 14H+ = 2Cr3+ + 3I2 + 7H2O (замещение);
I2 + 2S2O32– = S4O62– + 2I– (титрование).
По закону эквивалентов:
n (Pb2+) = n (CrO42–) = n (I2) = n (S2O32–);
2Pb2+ ≡2CrO42– ≡ Cr2O72– ≡ 3I2 ≡ 6S2O32– ≡ 6e;
fэкв (Pb2+) = 1/3; М(1/3 Pb2+) = 1/3М(Pb2+) = 207,2/3 = 69,07 г/моль.
Для расчета содержания свинца при титровании по заместителю можно использовать формулу (см. табл. 1.3):
m(Pb2+) =;
m(Pb2+) =  = 0,2197 г;
= 0,2197 г;
с(Pb2+) =  =
= 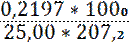 = 0,0424 моль/л
= 0,0424 моль/л
Пример 10.* При получении экстракционной фосфорной кислоты из фосфоритной муки протекают следующие основные реакции:
а) Ca3(PO4)2 + 3H2SO4 = 3CaSO4↓ + 2Н3PO4 или
б) 2Ca3(PO4)2 + 5H2SO4 = 5CaSO4↓ + Ca(Н2PO4)2 + 2Н3PO4.
От направления процесса зависит состав реакционной массы. Контроль процесса осуществляется методом кислотно-основного титрования.
Для анализа взяли 5,00 мл фильтрата реакционной массы и разбавили в мерной колбе до 250,0 мл. На титрование аликвоты 25,00 мл с индикатором метиловым оранжевым (м.о.) израсходовано 20,10 мл раствора NaOH с Т (NaOH/H2SO4), равным 0,004901 г/мл. На титрование такого же объема с фенолфталеином (ф.ф.) израсходовано 35,80 мл того же раствора NaOH. Интервал рН перехода окраски м.о. 3,1 – 4,4; ф.ф. 8,2 – 9,8.
Установите, при избытке или недостатке H2SO4 проводился процесс, в зультате которого получена указанная реакционная
масса. Вычислите концентрации каждого из компонентов в реакционной массе (г/л).
Р е ш е н и е.
Возможные реакции титрования:
H2SO4 + 2NaOH = Na2SO4+ 2Н2О (с м.о. и с ф.ф.),
Н3PO4 + NaOH = NaН2PO4 + Н2О (с м.о.),
поскольку рНТЭ1 = 1/2(рКа1+ рКа2) = 1/2(2,15+7,21) = 4,68;
Н3PO4 + 2NaOH = NaН2PO4 + 2Н2О (с ф.ф.),
поскольку рНТЭ2 = 1/2(рКа2+ рКа3) = 1/2(7,21+12,3) = 9,76;
Ca(Н2PO4)2 + 2NaOH = CaНPO4 + Na2НPO4 + 2Н2О (с ф.ф.).
Для случая а) 1/2 V (NaOH с ф.ф.) < V (NaOH с м.о.);
для случая б) 1/2 V (NaOH с ф.ф.) > V (NaOH с м.о.).
По данным анализа: 1/2V(NaOH с ф.ф.) = 35,80/2 = 17,9 мл,
что < V (NaOH с м.о.) = 20,10 мл, следовательно, реакционная масса содержит H2SO4 и Н3PO4.
Найдем расход щелочи на 1 эквивалент Н3PO4:
ΔV1 (NaOH) = V (NaOH с ф.ф.) - V (NaOH с м.о.) = 35,8 – 20,1 = 15,7 мл.
Найдем расход щелочи на 2 эквивалента H2SO4:
ΔV2 (NaOH) = V (NaOH с м.о.) - ΔV1 (NaOH) = 20,1 – 15,7 = 4,4 мл.
ρ(H2SO4)=  =
=  =43,1г/л;
=43,1г/л;
ρ(Н3PO4) =;
ρ(Н3PO4) =  = 307,8 г/л.
= 307,8 г/л.
Таблица 1.3.
Формулы для расчета массы определяемого вещества по результатам титрования при разных способах выражения концентрации титранта
| Прием титрования | Обратное (по остатку, по избытку) | Cпособ отдельных навесок: m(A) =  Способ пипетирования (аликвот): m(A) = Способ пипетирования (аликвот): m(A) =  | Cпособ отдельных навесок: m(A) = [  ]*M(fэквA) Способ пипетирования (аликвот): m(A) =[ *M(fэквA)* ]*M(fэквA) Способ пипетирования (аликвот): m(A) =[ *M(fэквA)*  | Cпособ отдельных навесок: m(A) = [T(B1/A)*V(B1) - T(B2/A)*V(B2)] Способ пипетирования (аликвот): m(A) = [T(B1/A)*V(B1) - T(B2/A)*V(B2)]*  |
| Прямое и заместителя | Способ отдельных навесок: m(A) = Способ пипетирования (аликвот): m(A) = | Способ отдельных навесок: m(A) =  Способ пипетирования (аликвот): m(A) = Способ пипетирования (аликвот): m(A) =  | Способ отдельных навесок: m(A) = T(B/A)*V(B). Способ пипетирования (аликвот): m(A) = T(B/A)*V(B)*  . . | |
| Способ расчета | По с(fэквB) (по молярной концентрации эквивалента рабочего раствора) | По Т(B) (по титру рабочего раствора В) | По Т(В/А) (по титру рабочего раствора В по определяемому веществу А) |
1. Лурье, Ю. Ю. Справочник по аналитической химии / Ю. Ю. Лурье. – М.: Химия, 1980. – 480 с.
2. Золотов, Ю. А. Основы аналитической химии. В 2 кн. Кн.1. Общие вопросы. Методы разделения: учеб. для вузов / Ю. А. Золотов, Е. Н. Дорохова В. И. Фадеева и др.; под ред. Ю. А. Золотова. – М.: Высш. шк., 1999. – 351 с.; Кн. 2. Методы химического анализа. – М.: Высш. шк., 1999. – 494 с.
3. Скуг, Д. Основы аналитической химии. Т. 1. / Д. Скуг, Д. Уэст; пер. с англ.– М.:Мир, 1979. – 480 с.
4. Основы аналитической химии. Задачи и вопросы: учеб. пособие для вузов / В. И. Фадеева, Ю. А. Барбалат, А. В. Гармаш и др.; под ред. Ю. А. Золотова. – М.: Высш. шк., 2002. – 412 с.
5. Дорохова, Е. Н. Задачи и вопросы по аналитической химии / Е. Н. Дорохова, Г. В. Прохорова. – М.: Мир, 2001. – 267 с.
6. Васильев, В. П. Аналитическая химия. В 2 кн. Кн. 1. Титриметрические и гравиметрический методы анализа: учеб. для студ. вузов / В. П. Васильев. – М.: Дрофа, 2002. – 368 с.
7. Васильев, В. П. Аналитическая химия. Сборник вопросов, упражнений и задач: пособие для вузов / В. П. Васильев, Л. А. Кочергина, Т. Д. Орлова; под ред. В. П. Васильева. – Васильев, В. П. Аналитическая химия. Дрофа, 2003. – 320 с.
8. Дорохова, Е. Н. Задачи и вопросы по аналитической химии: практ. пособие / Е. Н. Дорохова, Г. В. Прохорова. – М.: Изд-во МГУ, 1984. – 216 с.
9. Васильев, А. М. Сборник задач по аналитической химии. Ч.2 / А. М. Васильев и др. Изд-во Казанского ун-та, 1971. – 121с.
10. Сборник вопросов и задач по аналитической химии / под ред. В. П. Васильева. – М.: Высшая школа, 1976. – 216 с.
11. Воскресенский, А. Г. Сборник задач и упражнений по аналитической химии / А. Г. Воскресенский и др. – М.: Просвещ., 1985. – 174 с.
12. Клещев, Н. Ф. Задачник по аналитической химии / Н. Ф. Клещев и др. – М.: Химия, 1993. – 224 с.
13. Толстоусов, В. Н. Задачник по количественному анализу / В. Н. Толстоусов, С. М. Эфрос. – Л.: Химия, 1986. – 160 с.
14. Харитонов, Ю. А. Аналитическая химия (аналитика). В 2 кн. Кн.1. Общие теоретические основы. Качественный анализ: учеб. для вузов / Ю. Я. Харитонов. – М.: Высш. шк., 2001. – 615 с. Кн.2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высш. шк., 2003. – 559 с.
15. Цитович, И. К. Курс аналитической химии / И. К. Цитович. – М.: Высш. шк., 1977. – 330с. – М.: Высш.шк., 1994. – 495 с.
16. Бончев, П. Р. Введение в аналитическую химию / П. Р. Бончев. – Л.: Химия, 1978. – 487 с.
17. Дерффель, К. Статистика в аналитической химии / К. Дерффель, пер. с нем. – М.: Мир, 1994. – 247 с.
18. Чарыков, А. К. Математическая обработка результатов химического анализа / А. К. Чарыков. – М.: Химия, 1984. – 167 с.
 2017-11-01
2017-11-01 5707
5707