Содержание
Глава 1. ТЕПЛОТА.. 3
Основные понятия, законы и формулы.. 3
Решение задач. Примеры.. 4
Задачи к главе 1. 12
Глава 2. ТЕПЛОВОЕ РАСШИРЕНИЕ ТВЕРДЫХ И ЖИДКИХ ТЕЛ.. 15
Основные понятия, законы и формулы.. 15
Решение задач. Примеры.. 15
Задачи к главе 2. 19
Глава 3. ГАЗЫ... 21
Основные понятия, законы и формулы.. 21
Решение задач. Примеры.. 23
Задачи к главе 3. 33
Глава 4. НАСЫЩАЮЩИЕ И НЕНАСЫЩАЮЩИЕ ПАРЫ. ВЛАЖНОСТЬ.. 40
Основные понятия, законы и формулы.. 40
Решение задач. Примеры.. 41
Задачи к главе 4. 45
Глава 1. ТЕПЛОТА
Основные понятия, законы и формулы
1. Все тела состоят из атомов и молекул, находящихся в непрерывном беспорядочном движении. Хаотическое движение молекул тела называют тепловым движением. Каждая молекула вещества обладает кинетической и потенциальной энергией, поэтому всякое тело, наряду с механической энергией направленного движения частиц, обладает внутренней энергией.
В молекулярной физике под внутренней энергией подразумевают часть ее: кинетическую энергию хаотического движения микрочастиц (молекул, атомов, ионов, свободных электронов) и потенциальную энергию их взаимодействия друг с другом. Все другие виды внутренней энергии тел (энергия электромагнитного излучения, электронных оболочек, внутриядерная) считаются неизменными и не влияющими на рассматриваемые процессы:
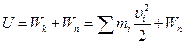
Изменение внутренней энергии и передача ее от одного тела к другому происходит в процессе взаимодействия тел. Есть два способа, две формы такого взаимодействия. При первом способе внутренняя энергия одного тела изменяется за счет изменения энергии упорядоченного (механического) движения частиц другого тела (механической работы, электризации, перемагничивания, облучения).
Мерой изменения энергии упорядоченного движения частиц вещества в процессе макроскопического взаимодействия тел служит работа А. Во втором случае изменение внутренней энергии происходит вследствие соударения хаотически движущихся молекул соприкасающихся тел.
Процесс изменения внутренней энергии тела, обусловленный передачей теплового движения молекул без совершения работы внешней средой, называют тепловым процессом или процессом теплопередачи.
Мерой взаимодействия тел, приводящего к изменению энергии хаотического движения и взаимодействия молекул (мерой энергии хаотического движения, переданной от одного тела к другому в процессе теплообмена), служит величина Q, называемая количеством теплоты.
2. Количество теплоты, подведенное к телу (системе тел) идет в общем случае на изменение внутренней энергии тела и на совершение телом работы над внешними телами (первое начало термодинамики – закон сохранения и превращения энергии с учетом тепловых явлений):
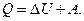 (1.1)
(1.1)
Количество теплоты Q, сообщенное телу, считают при этом положительным, отданное телом – отрицательным. Работу считают положительной, если тело за счет своей внутренней энергии совершает работу над внешней средой, и отрицательной, если работа совершается над телом и за счет работы увеличивается внутренняя энергия.
Количество теплоты и работа являются мерами изменения внутренней энергии, количество теплоты – в процессе теплопередачи, работа – в процессе превращения механической энергии в теплоту.
3. Если при подведении к телу количества теплоты Q температура тела повышается на  , то теплоемкость тела в рассматриваемом процессе равна:
, то теплоемкость тела в рассматриваемом процессе равна:
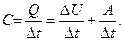 (1.2)
(1.2)
Удельная теплоемкость тела массой m:
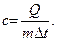 (1.3)
(1.3)
Если суммарная кинетическая энергия теплового движения молекул изменяется при неизменной потенциальной энергии, то изменение внутренней энергии тела массой m, равно:
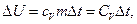 (1.3’)
(1.3’)
где 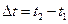 – изменение температуры тела, c V – удельная теплоемкость и C V – теплоемкость тела, взятые при постоянном объеме (А=0).
– изменение температуры тела, c V – удельная теплоемкость и C V – теплоемкость тела, взятые при постоянном объеме (А=0).
4. Тела могут находиться в одном из трех агрегатных состояний – твердом, жидком или газообразном – и при определенных условиях могут переходить из одного состояния в другое. Эти превращения происходят или в процессе теплообмена тела с окружающими телами, или вследствие перераспределения внутренней энергии в самом теле.
а) При плавлении кристаллических тел за счет теплоты, подводимой к телу (при А=0), потенциальная энергия атомов или молекул вещества, имеющего массу m, возрастает на величину
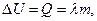 (1.4)
(1.4)
где l - удельная теплота плавления.
В процессе кристаллизации потенциальная энергия уменьшается на такую же величину, и соответствующее количество теплоты отводится к окружающим телам. Кинетическая энергия атомов при этом почти не меняется.
б) Если при испарении жидкости образуется пар массой m, то потенциальная энергия молекул пара увеличивается, а кинетическая энергия молекул, остающихся в жидкости, уменьшается на величину
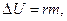 (1.5)
(1.5)
где R — удельная теплота испарения. Внутренняя энергия системы пар — жидкость при этом остается неизменной. Если процессу испарения сопутствует теплообмен с окружающей средой, в результате которого температура жидкости остается постоянной, то количество подводимой к ней теплоты определяется той же формулой (1.5).
При образовании пара массой m в процессе кипения жидкости внутренняя энергия молекул возрастает на величину
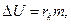
где Rk – удельная теплота кипения, являющаяся частным значением удельной теплоты испарения жидкости для температуры кипения. Внутренняя энергия системы в процессе кипения (при А =0) увеличивается за счет подвода к жидкости соответствующего количества теплоты извне.
в) В процессе химического соединения у ряда веществ перестраивается структура молекул, в результате чего резко увеличивается их кинетическая энергия. Такие процессы называют процессами горения, а участвующие в них тела – топливом и окислителем.
При полном сгорании топлива массой m внутренняя энергия теплового движения молекул возрастает на величину
 (1.6)
(1.6)
где q – удельная теплота сгорания топлива при данном окислителе.
 2017-11-01
2017-11-01 523
523







