Релятивистік импульс мына формуламен өрнектеледі
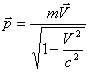 . (4.13)
. (4.13)
 қатынасымен өрнектелетін динамиканың негізгі заңы (4.13) өрнегін ескерсек, релятивистік қозғалыстар үшін де дұрыс болады.
қатынасымен өрнектелетін динамиканың негізгі заңы (4.13) өрнегін ескерсек, релятивистік қозғалыстар үшін де дұрыс болады.
Жалпы жағдайда, динамиканың релятивистік заңы бойынша 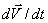 және
және 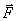 векторларының бағыттар сәйкес келмейді, үдеу мен күш шамалары арасындағы пропорционалдық бұзылады.
векторларының бағыттар сәйкес келмейді, үдеу мен күш шамалары арасындағы пропорционалдық бұзылады.
4.6 Масса мен энергияның өзара байланыс заңдылығы
Дененің толық энергиясы деп аталатын 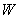 шамасын қарастырайық
шамасын қарастырайық
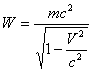 . (4.14)
. (4.14)
Дененің толық энергиясы оң шама және тыныштық күйде ол нөлге тең емес. 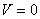 кездегі дененің толық энергиясы
кездегі дененің толық энергиясы 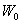 тыныштық энергиясы деп аталады
тыныштық энергиясы деп аталады
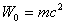 . (4.15)
. (4.15)
(4.15) формуласы дененің тыныштық энергиясы мен оның массасы арасындағы өзара байланысты орнықтырады. Кез келген денеде масса мен энергияның бір-біріне пропорционал болатындығын көрсетеді. Дененің тыныштық энергиясының әрбір өзгерісі оның массасының пропорционалдық өзгерісін тудырады.
Қозғалыс энергиясы, яғни кинетикалық энергия да - толық энергияның бір бөлігі. Сондықтан дененің кинетикалық энергиясы толық энергия мен тыныштық энергиясының айырмасы ретінде анықталады
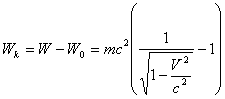 . (4.16)
. (4.16)
Энергия мен импульс бір-бірінен бөліп қарастырғанда салыстырмалы, яғни әртүрлі санақ жүйелерінде мәндері әртүрлі болады. Бірақ 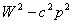 біріккен комбинациясы түрінде олар Лоренц түрлендіруіне қатысты инвариантты болатын бөлшек күйінің абсолютті сипатамасын береді. Осы шаманың инвариантты болуына байланысты импульс пен энергияның релятивистік өзара байланысы шығады: бір инерциялық санақ жүйесінен екінші инерциялық санақ жүйесіне көшкенде бөлшектің импульсі мен энергиясы
біріккен комбинациясы түрінде олар Лоренц түрлендіруіне қатысты инвариантты болатын бөлшек күйінің абсолютті сипатамасын береді. Осы шаманың инвариантты болуына байланысты импульс пен энергияның релятивистік өзара байланысы шығады: бір инерциялық санақ жүйесінен екінші инерциялық санақ жүйесіне көшкенде бөлшектің импульсі мен энергиясы 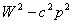 комбинациясы сақталып қалатындай болып өзгереді.
комбинациясы сақталып қалатындай болып өзгереді.
№5 дәріс. Статистикалық таралулар
Дәрістің мақсаты:
- статистикалық және термодинамикалық зерттеу әдістерінің маңыздылығын анықтау;
- классикалық статистикалық физиканың негізгі заңдарын оқып үйрену.
5.1 Статистикалық және термодинамикалық зерттеу әдістері
Статистикалық физика және термодинамика – макроскопиялық физикалық жүйелердің ортақ қасиеттерін зерттейтін бір-бірімен сабақтас физиканың бөлімдері.
Ең абсолютті сенімді принцип болып саналатын термодинамика бастамалары негізінде тәжірибелерде тікелей өлшенетін шамалармен (макроскопиялық параметрлер: көлем, температура, қысым және т.б.) сипатталатын материялық денелердің қасиеттерін зерттеу термодинамиканың негізгі тапсырмасы болып табылады. Бұл жағдайда заттың құрылымы жөнінде ешқандай модельдік көріністер қарастырылмайды. Термодинамиканың күші термодинамика бастамалары қаншалықты сенімді болып табылса, оның қорытындыларының сондай дәрежеде болуында.
Статистикалық физика макроденелердің құрылымы жөніндегі атом-молекулалық көрініс моделі (мысалы, идеал газ моделі) және математикалық статистикаға негізделген. Макрожүйелердің қасиеті жүйені құрайтын бөлшектердің қасиеті бойынша, олардың қозғалысының ерекшеліктері және осы бөлшектердің динамикалық сипаттамаларының (энергия,жылдамдық және т.б.) орташа мәндері бойынша анықталады. Статистикалық физика орташа шамаларды есептеу әдістерін және олардың көмегімен жүйенің макропараметрлерін анықтауға үлкен мүмкіндік береді. Молекула-кинетикалық теорияның негізгі теңдеуі осындай жолмен алынған
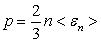 , (5.1)
, (5.1)
мұндағы p – газдың қысымы;
n – бірлік көлемдегі газ молекулаларының саны (молекула концентрациясы);
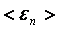 – молекулалардың ілгерілемелі қозғалысының орташа энергиясы.
– молекулалардың ілгерілемелі қозғалысының орташа энергиясы.
Бұл екі әдістің өзіндік жетістіктері де, кемшіліктері де бар. Оларды үйлестіре қолдану дәл және сенімді нәтиже береді.
5.2 Еркіндік дәрежесі бойынша энергияның біркелкі таралу заңы
Негізгі ұғымдар: молекуланың еркіндік дәреже саны i, ілгерілемелі, айналмалы және тербелмелі еркіндік дәрежелері.
Еркіндік дәрежесі бойынша энергияның біркелкі таралу заңы - классикалық жүйелерге қолданатын статистиканың негізгі заңдарының бірі. Жүйенің еркіндік дәреже саны деп оның кеңістіктегі орнын анықтайтын тәуелсіз координаталардың санын айтады. Олай болса, бір атомды молекулалар үш ілгерілемелі еркіндік дәрежеге, екі атомды молекулалар – үш ілгерілемелі, және екі айналмалы, көп атомды молекулалар және абсолютті қатты дене – үш ілгерілемелі және үш айналмалы еркіндік дәрежесіне ие болады. Жылулық тепе-теңдік жағдайында молекуланың әр еркіндік дәрежесіне 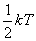 тең орташа бірдей кинетикалық энергиядан келеді. Мұндағы,
тең орташа бірдей кинетикалық энергиядан келеді. Мұндағы, 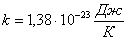 - Больцман тұрақтысы. Екі немесе көп атомды молекулалар айналмалы және тербелмелі қозғалыстар жасайды. Тербелмелі қозғалыстың болуы кинетикалық энергияның потенциалдық энергияға ауысуынан және керісінше болуымен байланысты. Молекуладағы атомның тербеліс энергиясын ескерсек, орташа кинетикалық және орташа потенциалдық энергиясын қарастыруымыз қажет. Молекуланың толық энергиясы
- Больцман тұрақтысы. Екі немесе көп атомды молекулалар айналмалы және тербелмелі қозғалыстар жасайды. Тербелмелі қозғалыстың болуы кинетикалық энергияның потенциалдық энергияға ауысуынан және керісінше болуымен байланысты. Молекуладағы атомның тербеліс энергиясын ескерсек, орташа кинетикалық және орташа потенциалдық энергиясын қарастыруымыз қажет. Молекуланың толық энергиясы
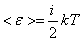 , (5.2)
, (5.2)
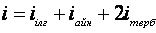 , (5.3)
, (5.3)
мұндағы i – молекуланың еркіндік дәреже саны.
5.3 Молекулалардың жылдамдық бойынша таралуына арналған Максвелл заңы
Термодинамикалық тепе-теңдік күйде тұрған газды қарастырайық. Оның бөлшектерінің қозғалысы классикалық механика заңдарына бағынады. Газда N молекула бар, әр молекуланың массасы m. Жылулық хаосты қозғалыс молекулалардың таралуы қозғалыс бағыты бойынша біркелкі болуымен сипатталады (барлық бағыттар бірдей ықтималды). Бірақ молекула жылдамдықтарының сандық мәндері бірдей бола алмайды, соқтығысу нәтижесінде молекулалардың жылдамдық бойынша уақытқа тәуелсіз қандай да бір таралуы орнығу керек.
Егер газ молекулаларының жылдамдықтары 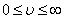 мәндерін қабылдаса, онда N жалпы молекулалар санының қаншасы dN берілген жылдамдықтан қандай да бір
мәндерін қабылдаса, онда N жалпы молекулалар санының қаншасы dN берілген жылдамдықтан қандай да бір 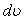 интервалда жататын жылдамдыққа ие болады деген сұрақ туындайды
интервалда жататын жылдамдыққа ие болады деген сұрақ туындайды
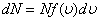 . (5.4)
. (5.4)
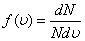 (5.5)
(5.5)
функциясы молекулалардың жылдамдық бойынша таралу функциясы деп аталады. Оның мәні мынада: 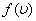 функциясы жылдамдықтары жылдамдықтың
функциясы жылдамдықтары жылдамдықтың 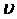 берілген мәнінен бірлік интервалда жататын молекулалардың үлесін анықтайды.
берілген мәнінен бірлік интервалда жататын молекулалардың үлесін анықтайды. 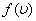 функциясы нормалау шартын
функциясы нормалау шартын 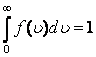 қанағаттандырады.
қанағаттандырады.
Газ молекулаларының жылдамдық бойынша таралымы жөніндегі есепті 1859 – 1860 ж.ж. Дж. К. Максвелл тұжырымдап, шығарған. Максвелдің таралу функциясы 5.1 суретінде көрсетілген және келесі формуламен өрнектеледі
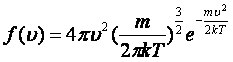 . (5.6)
. (5.6)
Кез келген таңдап алынған молекуланың жылдамдығының 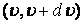 интервалында жату ықтималдылығы
интервалында жату ықтималдылығы 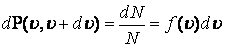 тең.
тең.
 |
5.1 Сурет
Максвелл таралуының негізгі қасиеттері:
- Молекулалардың өте аз үлесі ғана өте кіші және өте үлкен жылдамдықтарға ие болады;
- 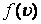 функциясының максимумына сәйкес келетін ықтималдық жылдамдық болады, сондықтан молекулалардың едәуір бөлігі
функциясының максимумына сәйкес келетін ықтималдық жылдамдық болады, сондықтан молекулалардың едәуір бөлігі 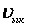 жылдамдыққа жақын жылдамдықпен қозғалады
жылдамдыққа жақын жылдамдықпен қозғалады
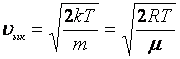 ; (5.7)
; (5.7)
- Таралу қисығының симметриялы болмауына байланысты жылдамдығы 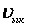 -тан жоғары молекулалардың үлесі
-тан жоғары молекулалардың үлесі 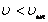 жылдамдықтағы молекулалар үлесіне қарағанда әрдайым жоғары болады. Бұл диспропорция температура артқан сайын күшейеді (
жылдамдықтағы молекулалар үлесіне қарағанда әрдайым жоғары болады. Бұл диспропорция температура артқан сайын күшейеді (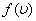 функциясы графигінде
функциясы графигінде 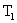 және
және 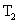 -ге арналған қисықтар).
-ге арналған қисықтар).
- Таралу функциясын біле отырып, жылдамдыққа тәуелді кез келген физикалық шаманың орташа мәнін анықтауға болады. Орташа арифметикалық жылдамдық
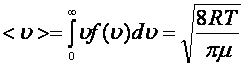 . (5.8)
. (5.8)
Орташа квадраттық жылдамдық
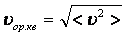 ;
; 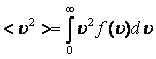 ;
; 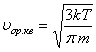 . (5.9)
. (5.9)
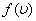 таралуы бөлшектердің бір-бірімен өзара қалай әсерлескеніне тәуелсіз. Ол тепе-теңдік күйдің орнығу процесінде бөлшектердің энергиямен алмасу қабілетімен анықталады.
таралуы бөлшектердің бір-бірімен өзара қалай әсерлескеніне тәуелсіз. Ол тепе-теңдік күйдің орнығу процесінде бөлшектердің энергиямен алмасу қабілетімен анықталады.
Максвелл заңында қисықтың түрі температураға байланысты болады. Жүйенің температурасы жайлы жылдамдықтары Максвелл заңы бойынша таралатын жүйедегі бөлшектердің жылулық (хаосты) қозғалысы орныққан жағдайда айтуға болады.
5.4 Сыртқы потенциалды өрістегі бөлшектердің таралуына арналған Больцман заңы
Жылулық қозғалыс кезінде бөлшектің қозғалыс бағыттары тең ықтималды, ал әр бөлшектің орнында болатын өзгерістер кездейсоқ сипатқа ие. Сондықтан бөлшектің сол немесе басқа орында болу ықтималдылығы жөнінде айтуға тура келеді.
Идеал газ V көлемді алып тұр және T температурада тепе-теңдік күйде тұр деп айтайық. Сыртқы өріс жоқ кезде кез келген молекуланың орналасуы тең ықтималды. Сондықтан газ барлық көлемде бірдей 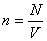 концентрациямен таралады.
концентрациямен таралады.
Егер газ сыртқы күш өрісінде орналасқан болса, газ бөлшектері осы өрістің әсеріне ұшырайды. Газдың тығыздығы мен қысымы әр жерде әртүрлі мәнге ие болады. Сыртқы күш өрісі потенциалды және тек бір z бағытында ғана әсер ететін жағдайды қарастырайық. Бөлшектің потенциалдық энергиясын 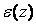 деп белгілейік. Жылулық тепе-теңдік жағдайында сыртқы күш өрісінің әсеріне түскен газ бөлшектерінің концентрациясы
деп белгілейік. Жылулық тепе-теңдік жағдайында сыртқы күш өрісінің әсеріне түскен газ бөлшектерінің концентрациясы
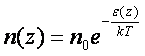 (5.10)
(5.10)
заңы бойынша өзгереді. Бұл қатынас Больцман заңы деп аталады. Жердің тартылыс өрісін қарастырайық. Жер бетіне жақын жерде молекуланың потенциалдық энергиясы 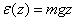 .
. 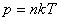 екенін ескерсек, жер бетінен z биіктіктегі газдың қысымының өрнегін аламыз:
екенін ескерсек, жер бетінен z биіктіктегі газдың қысымының өрнегін аламыз:
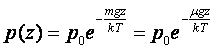 . (5.11)
. (5.11)
Бұл өрнек барометрлік формула деп аталады. Оны едәуір сиретілген газдар қоспасы (ауа) үшін де қолдануға болады.
Бұл екі қарастырылған таралуларды Максвелл-Больцман заңы деп біріктіріп қарастыруға да болады. Нақты газдар үшін ол тек бір-бірінен алыс қашықтықтағы молекулалар арасында өзара әсерлесуді ескермеген кезде ғана қолданылады. Өте төмен температурада (азғындалған газдар аймағы) молекулалардың қозғалысы классикалық заңдарға бағынбайды.
№6 дәріс. Термодинамиканың негіздері
Дәрістің мақсаттары:
- термодинамиканың заңдарын (бастамаларын) оқып үйрену;
- макрожүйеде өтетін процестерді талдауда оларды қолдану әдістерін меңгеру.
6.1 Жылу мен жұмыс - термодинамикада энергия алмасу формалары. Термодинамиканың бірінші бастамасы
Макроскопиялық денелердің U ішкі энергиясы бөлшектер жүйесінің механикалық энергиясынан сапалық жағынан ерекшеленеді. Бұл айырмашылық ішкі энергияны өзгертудің екі формасы – жұмыс пен жылу болған кезде ғана байқалады.
Жүйенің қоршаған ортамен күштік өзара әсерлесу кезінде оның ішкі энергиясының өзгеру шамасы А жұмысты береді. Жұмыстың атқарылуы жүйенің сыртқы параметрлерінің (мысалы, көлем) өзгеруі арқылы жүретін қандай да бір реттелген қозғалыстың пайда болуына байланысты. Сыртқы параметрлердің өзгерісінсіз жылу алмасу процестерінде ішкі энергиясының өзгеру шамасы Q жылуды береді. Жылу алмасу механизмдері: жылу өткізгіштік, сәуле шығару, конвекция.
Жылу мен жұмыс энергия түрлері емес, олар - энергияның алмасу формалары.
Жүйе мен қоршаған ортаның арасындағы энергия алмасуының екі тәсілі бар деп тұжырымдалатын термодинамикадағы энергияның сақталу заңы физиканың негізгі заңдарының бірі болып табылады:
Жүйеге берілген жылу мөлшері және жүйеде атқарылған жұмыс жүйенің ішкі энергиясын өзгертуге жұмсалады
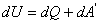 , немесе
, немесе  , (6.1)
, (6.1)
мұндағы 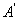 – жүйеде атқарылған жұмыс;
– жүйеде атқарылған жұмыс;
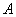 – сыртқы күштердің атқарған жұмысы.
– сыртқы күштердің атқарған жұмысы.
Ішкі энергия жүйенің күй функциясы болып табылады. Оның өзгерісі тек бастапқы және соңғы күйлеріне байланысты және бір күйден екінші күйге өту тәсіліне тәуелсіз.
Жылу мен жұмыс күйлерге ғана тәуелді болып қалмайды, сондай-ақ процестің түріне байланысты болады; олар процестің функциялары болып табылады.
6.2 Карно циклі. Карно теоремасы және Клаузиус теоремасы
Карно циклі барлық дөңгелек процестердің ішінде ерекше орын алады. Ол бір қыздырғыш 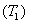 пен бір салқындатқыш
пен бір салқындатқыш 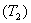 арқылы арқылы қайтымды түрде орындалатын бірден-бір цикл. Карно циклі екі изотерма және екі адиабатадан тұрады. Жұмыс денесін идеал газ деп алсақ, қайтымды Карно циклі үшін ПӘК-і
арқылы арқылы қайтымды түрде орындалатын бірден-бір цикл. Карно циклі екі изотерма және екі адиабатадан тұрады. Жұмыс денесін идеал газ деп алсақ, қайтымды Карно циклі үшін ПӘК-і
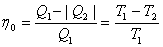 ,
,
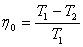 . (6.2)
. (6.2)
Карно теоремасы:
- Қайтымды Карно циклінің ПӘК-і жұмыстық дененің табиғатына және осы циклді жасайтын жүйенің құрылғысына тәуелсіз, ол тек қыздырғыш 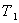 пен салқындатқыштың
пен салқындатқыштың 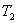 температуралары арқылы анықталады;
температуралары арқылы анықталады;
- Қайтымсыз машиналардың ПӘК-і (қайтымсыз цикл бойынша жұмыс істейтін) қайтымды машиналардың ПӘК-не қарағанда кіші, яғни 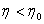 . Олай болса,
. Олай болса,
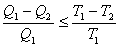 . (6.3)
. (6.3)
Макрожүйелерде нақты қайтымды процестер болуы мүмкін емес, сондықтан (6.2) өрнегі асимптотикалық сипатқа ие, яғни дәл мәнін көрсету мүмкін емес.
Карно теоремасы (6.3) термодинамиканың екінші заңының математикалық өрнегін береді, ол бір қыздырғышы мен бір салқындатқышы бар тұйық процестер үшін ғана қолданылады. (6.3)-гі теңдік белгісі қайтымды процестер үшін, теңсіздік белгісі – қайтымсыз процестер үшін қойылады.
Кез келген цикл жағдайында Карно теоремасының жалпылама түрі Клаузиус теңсіздігін береді (Клаузиус теоремасы)
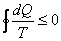 . (6.4)
. (6.4)
6.3 Энтропия. Энтропияның статистикалық түсіндірмесі
Кез келген қайтымды цикл үшін Клаузиус теоремасын (6.4) жазайық
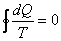 . (6.5)
. (6.5)
(6.5) интегралдың нөлге тең болуы 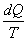 шамасы қандай да бір S күй функциясының толық дифференциалын береді. Сондықтан
шамасы қандай да бір S күй функциясының толық дифференциалын береді. Сондықтан
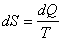 және
және 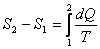 . (6.6)
. (6.6)
(6.6) формуласын термодинамикадағы энтропияның анықтамасы ретінде қарастыруға болады.
(6.6) анықтамадан туындайтын энтропияның кейбір қасиеттері:
- Жүйенің энтропиясы - аддитивті шама 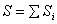 ;
;
- жылу алмасусыз жүретін қайтымды процесте 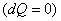 – адиабаталық процесте- энтропия тұрақты болады;
– адиабаталық процесте- энтропия тұрақты болады;
- процестің энтропиясы қандай да бір тұрақты шамаға дейінгі дәлдікпен анықталуы мүмкін.
Қайтымды процестегі энтропияның өзгерісі (6.1) және (6.5) қатынастары негізінде есептеледі
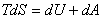 . (6.7)
. (6.7)
Жылулық процестерді талдау үшін координат осьтері ретінде T және S күй функциялары алынатын TS – диаграммасы қолданылады.
Энтропияның физикалық мағынасы статистикалық физикада нақтылана түседі. Л.Больцман S энтропияның микрокүйлер санының 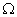 логарифмімен анықталатынын көрсетті
логарифмімен анықталатынын көрсетті
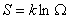 , (6.8)
, (6.8)
мұндағы k –Больцман тұрақтысы;
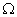 – берілген макрокүйдің статистикалық салмағы.
– берілген макрокүйдің статистикалық салмағы.
(6.8) формуласы Больцман формуласы деп аталады. Ол энтропияның мағынасын көрнекі түрде түсіндіріп береді.
Барлық атомдар белгілі орындарға мықтап бекітілген деп қарастырайық. Онда тек қана бір микрокүй бар деп айтуға болады, яғни 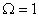 және
және 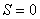 . Жүйеге қандай да бір жылу мөлшерін берсек, ішкі құрылымның ретсіздігін және оны құрайтын бөлшектердің қозғалысының бейберекетсіздігін арттырады (
. Жүйеге қандай да бір жылу мөлшерін берсек, ішкі құрылымның ретсіздігін және оны құрайтын бөлшектердің қозғалысының бейберекетсіздігін арттырады (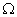 артады). Сондықтан, энтропияны ретсіздік өлшемі деп айтуға болады.
артады). Сондықтан, энтропияны ретсіздік өлшемі деп айтуға болады.
№7 дәріс. Термодинамиканың екінші бастамасы.
Дәрістің мақсаты:
- термодинамиканың бірінші заңы процестің өту бағытын көрсете алмайтынын түсіндіру;
- энтропияны күй функциясы мағынасында түсіндіру.
7.1 Дөңгелек процестер. Жылу машиналарының ПӘК-і
Термодинамиканың бірінші бастамасы жүйенің сыртқы денелерден алған жылу есебінен жұмысты атқару мүмкіндігі болатынын көрсетеді. Мысалы, 1-2 күйлердің арасында идеал газды изотермиялы ұлғайтса 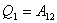 .
.
 2014-01-27
2014-01-27 1052
1052
