Белки выполняющие разные функции, имеют разные последовательности
Была обнаружена каждая из комбинаций двух последовательно соединенных аминокислот.
Не существует одной частичной последовательности, для всех белков.
Несколько важных обобщений, касающихся определения амиокислотной последовательности: общей
5) Одинаковые белки, выполняющие одинаковые функции, и выделенные из разных организмов имеют значительное сходство в последовательностях аминокислот.
6)одинаковые белки, выполняющие одинаковые функции и выделенные из организмов одного вида почти всегда обладают совершенно одинаковой последовательностью
2) Вторичная структура – определяется регулярно повторяющейся формой укладки полипептидных цепей в пространстве. Или, можно сказать, что это пространственная ориентация основной полипептидной цепи без учета различной по составу и конформации белковых цепей. Остов любой цепи:
R1 R2 R3
| | |
NH2-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-COOH
Мы уже говорили о том, что атомы углерода и азота в пептидной связи находятся в одной плоскости и поэтому исключают вращение. А вот альфа-углеродный атом и его радикал находятся под углом к основной цепи, да еще альфа-углеродный атом является ассиметричным, что и обуславливает вращение. Специфический тип ориентации (то-есть вторичная структура) является результатом того или иного вида свободного вращения вокруг связей цепи, соединяющих альфа-углеродные атомы. В природных полипептидных полипептидных цепях обнаружены 3 основных вида структуры:
1)Спираль; 2)Складчатая структура; 3)Статистический клубок.
В полипептидных цепях со спиральной структурой, состоящих из альфа-аминокислот, наиболее часто встречается правая альфа-спираль. Шаг спирали (один полный виток) равен 5,4 анстрем (А) (1А=10 в –10 степени метра). В один шаг укладывается 3,6 аминокислотных остатка. Такое построение альфа-спирали максимально соответствует тому, чтобы группы С=О одного витка соответствовали группам N-H другого (соседнего) витка. Это нужно для образования максимально большого количества водородных связей. Чем больше образуется водородных связей, тем меньше уровень свободной энергии, тем система более стабильна. Альфа-спираль в 1951 году математически расчитали Л.Полинг и Ф.Кори. Эксперементально это было доказано в 1957 году. Содержание альфа-спиралей в глобулярных белках сильно варьирует: от 0% до 80-90% (глобулярный белок не может иметь 100% спирализации, в этом случае он будет фибрилярным). Спиральную структуру могут нарушить 2 фактора: 1)Наличие остатков пролина, циклическая структура которого вносит излом в полипептидную цепь; 2)Существование локального электрического отталкивания, когда напротив друг друга оказываются либо положительно заряженные R-группы лизина и аргинина, либо отрицательно заряженные группы аспарагиновой и глбтаминовой кислот. Существуют и другие виды спиралей, например, бетта-спираль, 310 – спираль и т.д. Все они отличаются только параметрами: то-есть имеют различный шаг спирали и в один виток укладывается разное количество аминокислотных остатков. Складчатая структура (ее иногда называют бетта-складчатой) формируется на неспирализованных участках полипептидной цепи. Возникают водородные связи между двумя или большим числом цепей (как правило, в фибриллярных белках) или между различными участками одной цепи (в глобулярных белках). Есть 2 типа складчатой структуры в зависимости от взаимного положения атомов в различных цепях или участках одной цепи:
1)Параллельная (если обе цепи направлены в одну сторону, то-есть совпадают их N и С концы;
2)Антипараллельная (если С и N концы у двух цепей направлены в разные стороны). Более стабильным считается антипараллельное расположение, так как больше совпадений групп С=О и N-H, соответственно больше возникает и водородных связей.
Вторичная структура формируется путем самосборки, то-есть ее образование полностью зависит от аминокислотной последовательности полипептидной цепи, то-есть от первичной структуры. Изучают вторичную структуру с помощью рентгено-структурного анализа и поляриметрии.
Статистический клубок образуется в полипептидных цепях глобулярных белков на участках, не обладающих спиральной или складчатой структурой, вследствии упорядоченных взаимодействий с участием R-группы и образованием дисульфидных связей.
3) Третичная структура – это специфичная форма (для каждого белка) укладки полипептидных цепей в пространстве, то-есть она описывает полную трехмерную архитектуру белка, в том числе и ориентацию простетической группы.
Третичная структура фибриллярных белков: полипептидные цепи имеют полностью спирализованную структуру или полностью складчатую структуру. Интактный белок, однако, состоит не из одиночных пептидных цепей, а из агрегатов двух или большего числа полипептидных цепей. Например, белок шелка фиброин состоит из нескольких цепей со складчатой структурой, уложенных стопкой так, что каждая цепь со всех четырех сторон окружена антипараллельными цепями. Белок кератин (волосы, ногти и т.д.) представляет собой скрученные спиральные цепи, связанные в пучки или взаимоперекрученные. Для изучения третичной структуры глобулярных белков большое значение имели работы М.Перутца (1934 – 1959года – работал над третичной структурой гемоглобина) и Д.Кендрью (1947 – 1957года – миоглобин). Для расшифровки третичной структуры использовался метод рентгеноструктурного анализа, практически, единственный метод, пригодный для этих целей (поскольку разрешающая способность приблизительно равна 1,5 Ангстрем). В отличие от фибриллярных белков, конформация глобулярных белков гораздо более компактна из-за наличия сложным образом согнутых, свернутых и скрученных участков полипептидной цепи. Однако, не существует единой для всех глобулярных белков формы. Некоторые из них – почти правильные сферы, другие – вытянутые эллипсоиды, большинство – имеют промежуточную форму между этими крайними случаями. Необходимо помнить:
1)Нативная конформация белка – индивидуальное структурное свойство данного белка, которое, в свою очередь, определяет его индивидуальность. Зависимость биологической активности белка от его третичной структуры впервые показал Кристиан Анфинсен в 1964 году на примере РНКазы.
2)Нативная конформация определяется инструкциями, заложенными в аминокислотной последовательности. Нативная конформация (третичная структура) – это конформация с минимальной энергией, то-есть максимально стабильная конформация.
Стабилизация третичной структуры осуществляется за счет практически всех видов связей (водородные, электростатические, гидрофобные, взаимодействие в простетической группе – например, между ионом металла и различными R-группами). Сейчас третичная структура описана более, чем для 100 белков.
4)Четвертичная структура – определяется числом и пространственным расположением субъединиц белков, то-есть, по сути, четвертичная структура рассматривает нековалентное агрегирование двух и большего числа полипептидных цепей. Субъединица – это часть белковой молекулы, способная выполнять какую-то функцию. Четвертичная структура характерна для белков, существующих в виде агрегатов двух или большего числа полипептидных цепей, соединенных друг с другом посредством лишь нековалентных связей (электростатические и водородные связи). Ковалентные связи, например, дисульфидные мостики – отсутствуют. Белки такого типа называются олигомерными, соответственно есть и мономерные белки – 1 цепь. Причем чаще всего встречаются димеры, тримеры и тетромеры, хотя есть и белки с большим числом компонентов. Каждую отдельную цепь в составе таких белков называют протомером. Выделяют гомогенные олигомеры (у которых все протомеры идентичны) и гетерогенные олигомеры (у которых цепи различны). Иногда число субъединиц равно числу протомеров. Олигомерным белкам свойственны кооперативные изменения конформации протомеров. Это можно рассмотреть на примере миоглобина и гемоглобина. Миоглобин, белок из мышц млекопитающих, переносящий кислород, состоит из 153 аминокислотных остатков, образующих единичную полипептидную цепь. Кислород присоединяется к белку, связываясь с атомом железа в простетической группе – геме. Гемоглобин является гетерогенным тетрамером, он состоит из двух альфа-цепей и двух бетта-цепей. В каждой из цепей есть простетическая группа – гем, в которой происходит связывание кислорода с железом. Альфа-цепь имеет 141 аминокислотный остаток, бетта-цепь – 144. Миоглобин и по отдельности альфа- и бетта- цепи гемоглобина очень похожи по третичной структуре. Но полностью молекула гемоглобина (2альфа- + 2бетта- цепи) очень отличаются от миоглобина по конфигурации, вследствии кооперативных изменений протомеров. Поэтому, в случае гемоглобин первый связанный лиганд кислорода облегчает связывание второй молекулы кислорода со вторым гемом, что в свою очередь облегчает связывание 3й молекуле кислорода с третьим гемом, а это облегчает связывание последней молекулы кислорода. Графики насыщения кислородом выглядят так:

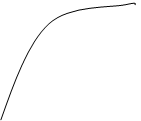


100---- 100----
РО2 рО2
Миоглобин Гемоглобин
По отдельности каждая цепочка гемоглобина имеет график насыщения кислородом идентичный с миоглобином. Суть объяснения сводится к тому, что белок может принимать различные трехмерные конформации, обладающие разной активностью.
Изучают с помощью рентгено структурного анализа.
Олигомерные белки значительно лучше регулируются, что способствует лучшему выполнению функции в меняющихся условиях среды. Четвертичная структура собирается также по принципу самосборки.
Некоторые олигомерные белки существуют в трех и более гибридных формах. Это явление открыто в 1957 году для липоилдегидрогеназы. Гибридные формы называют изоферментами. Клетки и биологические жидкости (например, кровь) обычно содержат изоферменты во вполне определенных, характерных ддя них соотнощениях. Измерение уровни изоферментов используются для диагностики различных патологий.
 2014-01-31
2014-01-31 1117
1117
