13.2.1. Теории растворов ВМС
В настоящее время распространена молекулярная теория растворов ВМС Штаудингера – достаточно разбавленные растворы содержат отдельные, друг с другом не связанные, макромолекулы. Поведение этих молекул в растворе сходно с поведением свернутых в клубки гибких нитей.
Молекулярный клубок при не слишком большой длине цепи еще не плотен, и сквозь просветы может проникать растворитель. По мере увеличения длины макромолекулы изогнутые участки цепи все больше закрывают просветы и в конце концов такой клубок почти полностью теряет способность пропускать растворитель.
Молекулярная теория находит подтверждение в ряде факторов:
1 определение молекулярных масс (например, методом светорассеяния) однозначно показало отсутствие в растворах мицелл;
2 растворение ВМС идет самопроизвольно, часто с выделением тепла;
3 растворы полимеров термодинамически устойчивы и могут храниться долго;
4 растворение ВМС не требует присутствия в системе специального стабилизатора;
5 растворы полимеров находятся в термодинамическом равновесии и являются обратимыми системами.
Утверждение, что молекулы полимеров не связаны друг с другом, верно лишь для разбавленных растворов. В концентрированных растворах, когда вероятность столкновения молекул велика, макромолекулы могут взаимодействовать и образовывать ассоциаты. Эти ассоциаты, состоящие из сравнительно малого числа молекул и представляющие собой прообраз пачек, обычно не обладают достаточной протяженностью и не могут считаться фазой. Явление ассоциации близко к явлению флуктуации плотностей в растворах.
Набухание ВМС. При контакте полимера с растворителем всегда происходит его набухание. Набухание – это самопроизвольный процесс поглощения низкомолекулярного растворителя высокомолекулярным веществом, сопровождающийся увеличением его массы и объема до 1000–1500 %. Набухание является начальным этапом растворения ВМС. Различают ограниченное и неограниченное набухание.
При ограниченном набухании объем и масса полимера достигают определенных значений и дальнейший контакт полимера с растворителем не приносит каких-либо изменений. Ограниченно набухший полимер называется студнем. Неограниченное набухание характеризуется отсутствием предела набухания, со временем полимер поглощает все большее количество жидкости и в результате набухание переходит в растворение. Примером ограниченного набухания является набухание резины в бензоле; набухание же каучука в этом растворителе неограниченно.
На характер набухания влияет температура. Так, желатин и агар-агар в холодной воде набухают до определенного предела, т. е. ограниченно, при нагревании же они набухают неограниченно и растворяются.
Причиной набухания является диффузия низкомолекулярного растворителя в высокомолекулярное вещество. Набухание можно представить как одностороннее смешивание, при котором молекулы низкомолекулярного вещества благодаря большой подвижности проникают в пространство между молекулами полимера. В большинстве случаев набухание включает не только простую диффузию молекул жидкости в полимер, но и сольватацию макромолекул. Если растворитель полярен, то сольватируются полярные группы макромолекул, если неполярен, то сольватируются неполярные группы. В зависимости от того, каких групп в полимере больше, он будет набухать в полярном или неполярном растворителе.
Процесс набухания можно разбить на две стадии. На первой стадии низкомолекулярный растворитель, диффундируя в высокомолекулярное вещество, сольватирует его макромолекулы. Процесс сопровождается выделением тепла. Молекулы растворителя в сольватной оболочке отличаются плотной упаковкой и растворитель в сольватной оболочке имеет более высокую плотность. На первой стадии набухания наряду с увеличением объема полимера наблюдается суммарное уменьшение объема всей системы.
На второй стадии набухания, идущей без теплового эффекта, наблюдается основное увеличение объема полимера. Молекулы жидкости диффундируют в полимер, и происходит смешивание больших и гибких макромолекул с молекулами растворителя.
Набухание полимера характеризуется степенью набухания:
a = 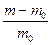 , (13.1)
, (13.1)
где m и m0 – масса полимера до и после набухания.
Если набухание ВМС идет в ограниченном пространстве, то возникает давление набухания, что может стать причиной разрыва емкости. Известен случай, когда стальной корпус судна был разорван набухшим в его трюме зерном.
13.2.2. Свойства растворов ВМС
При неограниченном набухании ВМС могут растворяться и образовывать растворы. Они по ряду свойств похожи на коллоидные растворы (золи), но вместе с тем имеют и различия. Благодаря большим размерам коллоидных частиц и макромолекул для растворов полимеров, как и для золей, характерна малая скорость диффузии частиц, неспособность их проникать через полупроницаемые перегородки. В свое время это послужило основанием считать растворы ВМС коллоидными растворами, однако по ряду признаков они отличаются от коллоидных растворов.
1. Растворение ВМС идет самопроизвольно.
2. Коллоидный раствор – гетерогенная система, растворы ВМС при не очень высоких концентрациях – системы гомогенные.
3. Растворы полимеров достаточно стойки и не изменяются со временем, т. е. они термодинамически устойчивы, а коллоидные растворы – термодинамически неустойчивые системы.
4. Растворы ВМС не требуют стабилизатора.
5. Растворы полимеров могут быть более концентрированными, чем коллоидные, иметь вполне измеримое осмотическое давление, их вязкость значительно выше вязкости растворителя.
Таким образом, растворы ВМС по своим основным признакам нельзя считать коллоидными системами. Это истинные молекулярные растворы, образующиеся самопроизвольно, термодинамически устойчивые и не нуждающиеся в стабилизаторе.
Однако следует иметь в виду, что ВМС могут быть получены и в коллоидном состоянии, если в качестве дисперсионной среды взять жидкость, в которой они молекулярно не растворяются или растворяются плохо. В этом случае макромолекулы свертываются в достаточно плотный клубок, который можно считать отдельной фазой, и такие растворы не отличаются от обычных золей.
Осмотическое давление и вязкость растворов ВМС. Наличие в растворах ВМС вытянутых гибких макромолекул влияет на осмотическое давление и вязкость. Для выражения осмотического давления растворов ВМС в уравнение Вант-Гоффа вводится дополнительный член, учитывающий взаимодействие гибких макромолекул друг с другом и с растворителем:
p = cRT/ М + вc2, (13.2)
где М – масса 1 моля, с – массовая концентрация, в – постоянная, зависящая от природы растворителя и растворенного вещества. Разделив правую и левую части уравнения на с, получим
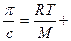 вс. (13.3)
вс. (13.3)
Графическая зависимость величины 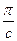 от с имеет вид прямой, не проходящей через начало координат (рис. 15.2). Отрезок, отсекаемый этой прямой на оси ординат, равен RT/ M. Определив осмотическое давление раствора какого-либо высокомолекулярного вещества при нескольких массовых концентрациях, строят графическую зависимость
от с имеет вид прямой, не проходящей через начало координат (рис. 15.2). Отрезок, отсекаемый этой прямой на оси ординат, равен RT/ M. Определив осмотическое давление раствора какого-либо высокомолекулярного вещества при нескольких массовых концентрациях, строят графическую зависимость 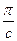 от с, находят RT/M, а затем М. Это один из самых распространенных методов определения молекулярной массы.
от с, находят RT/M, а затем М. Это один из самых распространенных методов определения молекулярной массы.
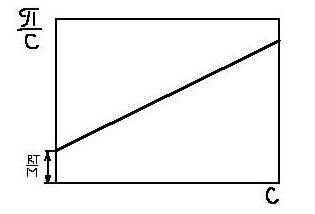
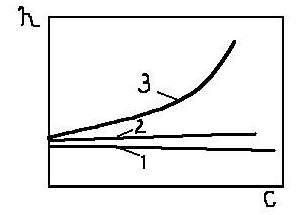
Рис. 13.2. Зависимость 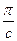 от концентрации раствора полимера
от концентрации раствора полимера
Зависимость вязкости НМВ (1), золя (2), раствора полимера (3)
По вязкости растворы ВМС резко отличаются от растворов низкомолекулярных веществ (НМВ) и золей. При одной и той же концентрации вязкость растворов полимеров значительно выше вязкости растворов НМВ и с увеличением концентрации она быстро возрастает (рис. 13.2, б). Такая высокая вязкость растворов ВМС, даже при низкой концентрации, объясняется наличием в системе длинных гибких макромолекул, они увеличивают силу трения между слоями, т. е. увеличивают вязкость.
Для характеристики вязкости разбавленных растворов полимеров, в которых макромолекулы не взаимодействуют друг с другом, Штаудингер предложил уравнение
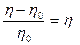 уд = kMc, (13.4)
уд = kMc, (13.4)
где h и h0 – вязкость раствора и растворителя; h уд – удельная вязкость раствора; k – константа для каждого полимергомологического ряда; М – молекулярная масса полимера; с – концентрация раствора, выраженная в “основных молях” на литр. “Основной моль” – число граммов полимера, равное молекулярной массе полимера, из которого построена макромолекула.
Константу k определяют, измеряя молекулярную массу наиболее низкомолекулярного члена данного полимергомологического ряда каким-либо другим методом.
Вязкость раствора полимера зависит от природы растворителя. Это обьясняется тем, что природа растворителя сильно влияет на форму макромолекул в растворе. В хороших растворителях молекула полимера сильно сольватирована, что придает ей жесткость, и она имеет вытянутую форму. В плохих растворителях сольватация макромолекул мала и ее отдельные части взаимодействуют друг с другом, в результате молекула сворачивается в клубок более или менее плотный. Чем лучше полимер растворяется в растворителе, тем более вытянуты макромолекулы и тем больше вязкость раствора.
С увеличением концентрации вязкость растворов полимеров не только возрастает непропорционально, но и течение этих растворов не подчиняется законам Ньютона и Пуазейля. Коэффициент вязкости этих растворов не является постоянным, а уменьшается с увеличением градиента скорости течения раствора. В этом отношении концентрированные растворы полимеров становятся похожими на структурированные коллоидные системы с частицами вытянутой формы. С увеличением скорости течения растворов гибкие макромолекулы распрямляются и ориентируются по направлению течения. Это снижает их гидродинамическое сопротивление движущейся жидкости и уменьшает вязкость раствора.
В растворах высокой концентрации возможно образование ассоциатов макромолекул, также имеющих вытянутую форму. Эти ассоциаты и макромолекулы, взаимодействуя друг с другом, образуют пространственные структуры, затрудняющие течение. Увеличение скорости течения ведет к разрушению этих структур и снижению вязкости растворов полимеров. Разрушение таких структур можно вызвать и чисто механическим путем – встряхиванием, перемешиванием. После прекращения воздействия структуры восстанавливаются и вязкость возрастает. Восстановление структуры полимеров после разрушения показывает, что для них характерна тиксотропия.
Увеличение концентрации полимера в растворе может привести к образованию прочной структуры, раствор потеряет текучесть и превратится в студень.
Агрегативная устойчивость. Растворы ВМС образуются самопроизвольно при контакте растворяемого вещества с растворителем. Растворение идет медленно и медленно, наступает равновесие. В растворенном состоянии растворы ВМС агрегативно устойчивы, как и истинные растворы низкомолекулярных веществ.
Для выделения ВМС из раствора необходимо уменьшить его растворимость. Обычно для этого добавляют какой-либо электролит. Этот процесс только внешне напоминает коагуляцию коллоидного раствора электролитами. Коагуляция золей происходит при не очень высокой концентрации электролита, для выделения же из раствора ВМС требуется очень большая концентрация электролита. Поэтому обычно этот процесс называется высаливанием.
При высаливании ВМС из водных растворов основное значение имеет не заряд ионов электролита, как при коагуляции, а способность их к гидратации. Наибольшим высаливающим действием обладают анионы, которые по активности можно расположить в следующий ряд:
C2O42-> SO42-> CH3COO-> Cl-> NO3-> Br-> J-> CNS-
Чем больше способность иона к гидратации, тем сильнее он будет связывать растворитель и уменьшать его растворяющую способность.
Высаливание можно проводить не только электролитами, но и органическими веществами (спиртом, ацетоном), способными взаимодействовать с водой (гидратироваться) и понижать растворимость ВМС.
В растворах ВМС при понижении температуры или при высаливании иногда наблюдается образование капелек второй жидкой фазы. Эта фаза является более концентрированным раствором высокомолекулярного вещества, приближающимся по свойствам к студням. Явление расслоения раствора ВМС на две жидкие фазы получило название коацервации.
Таким образом, растворы ВМС в отличие от обычных коллоидных систем не подвержены процессу собственно старения, а изменение некоторых их свойств при длительном стоянии обусловлено медленным действием присутствующих в них посторонних веществ.
 2014-01-31
2014-01-31 1342
1342
