| Определение | • (от греческих слов вода и разложение) процесс разложение соединений (чаще всего солей) под действием полярных молекул воды, приводящий к изменению реакции среды |
| Основные случаи гидролиза солей | • а) соли соответствует слабая кислота и сильное основание; в подобных случаях идет взаимодействие анионов соли с водой (гидролиз по аниону): KCN+HOHó HCN + KOH ионно-молекулярная форма CN¯+HOHó HCN + OH¯; ионы Н+ связаны c CN¯ в слабодиссоциирующую молекулу, а ионы OH¯ практически свободны, среда щелочная, pH>7; в случае гидролиза соли, образованной многоосновной кислотой образуются кислые соли Na2CO3 + H2Oó NaHCO3 + NaOH ионно-молекулярная форма CO32‾ + H2Oó HCO3‾ + OH‾; pH>7 (щелочная среда) б) соли соответствует сильная кислота и слабое основание – идет взаимодействие катиона с водой (гидролиз по катиону): NH4 NO3+HOH ó NH4OH+HNO3 NO3‾+HOH ó NH4OH+H+ ; ионы OH¯ связаны NH4+ в слабодиссоциирующую молекулу, а ионы Н+ практически свободны, среда кислая, pH<7; - в случае гидролиза соли, образованной многокислотным основанием, образуются основные соли ZnCl2 + H2O ó ZnOHCl + HCl Zn2+ + H2O ó ZnOH+ + H+; pH<7 (кислая среда) в) соли соответствует слабая кислота и слабое основание – взаимодействие катиона и аниона с водой (гидролиз по катиону и аниону, или полный гидролиз): Al2S3 + 6H2O ó 2Al (OH)3↓ + 3H2S↑; pH ≈7 (среда близка к нейтральной) г) соли соответствует cильная кислота и сильное основание. Нет взаимодействия ни с катионом, ни с анионом. Соль не подвергается гидролизу, (гидролиз не идет): NaCl + H2O ≠; pH = 7 (нейтральная среда) |
| Константа гидролиза, Kг | • количественная характеристика глубины протекания гидролиза а) при гидролизе соли, образованой слабой кислотой и сильным основанием: Kw Kг = ———, Kкислоты где Kкислоты – константа диссоциации слабой кислоты; - чем слабее кислота, тем меньше значение Kкислоты и тем больше значение Кг; б) при гидролизе соли, образованой сильной кислотой и слабым основанием: Kw Kг = ———, Kоснования где Kоснования – константа диссоциации слабого основания; - чем слабее основание, тем меньше значение Коснования и тем больше значение Кг; в) при гидролизе соли, образованой слабой кислотой и слабым основанием: Kw Kг = —————————, Kкислоты ∙ Kоснования |
| Степень гидролиза, h | • Nг h = ———, N0 где: N0 – общее число молекул исходной соли; Nг–число молекул вступивших во взаимодействие с водой |
| Связь константы и степени гидролиза | • в случае гидролиза по катиону или аниону:
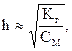 • в случае гидролиза, протекающего одновременно по катиону и аниону:
• в случае гидролиза, протекающего одновременно по катиону и аниону:
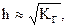 т.е. концентрация раствора соли практически не влияет на степень гидролиза т.е. концентрация раствора соли практически не влияет на степень гидролиза
|
Гидролиз
|
|

Сейчас читают про:
 2015-06-26
2015-06-26 351
351







