Количественной характеристикой процесса гидролиза является степень гидролиза b. Степень гидролиза равна отношению числа молекул соли, подвергшихся гидролизу, к общему числу молекул соли в растворе:
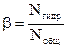
Степень гидролиза зависит от природы соли, температуры и концентрации раствора. Степень гидролиза связана с константой гидролиза соотношением, аналогичным закону разбавления Оствальда:
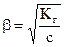 .
.
Таким образом, гидролиз усиливается при разбавлении раствора.
Поскольку гидролиз большинства солей заканчивается установлением равновесия, влияние различных факторов на протекание гидролиза можно предсказать, используя принцип Ле Шаталье.
Гидролиз – это эндотермический процесс (так как является обратным экзотермическому процессу нейтрализации), поэтому при повышении температуры гидролиз усиливается.
Равновесие процесса гидролиза может быть смешено введением в раствор кислоты или основания. В соответствии с принципом Ле Шаталье гидролиз соли, образованной сильным основанием и слабой кислотой подавляется при добавлении щелочи (так как это означает увеличение концентрации одного из продуктов гидролиза - ионов ОН-) и усиливается при добавлении кислоты (так как это означает уменьшение концентрации продукта гидролиза - ионов ОН-). Гидролиз соли, образованной катионом слабого основания и анионом сильной кислоты, по тем же причинам усиливается при добавлении щелочи и подавляется при добавлении кислоты. При гидролизе соли, образованной катионом слабого основания и анионом слабой кислоты, продукты гидролиза катиона (ионы Н+) и аниона (ионы ОН-) усиливают гидролиз друг друга.
Если в результате гидролиза соли образуются малорастворимые или газообразные продукты, которые удаляются из сферы реакции, то гидролиз необратим и протекает до конца. Такие соли водой полностью разлагаются и не могут существовать в водных растворах, например:
Al2S3+ 6H2O ® 2Al(OH)3+ 3H2S.
Рассмотрим примеры расчета рН растворов солей при гидролизе.
Пример1. Рассчитать рН 0,1М раствора NH4Cl.
Хлорид аммония – это соль, образованная катионом слабого основания и анионом сильной кислоты, гидролизуется по аниону:
NH + H2O = NH4OH + H+
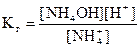
В соответствии с уравнением реакции гидролиза:
[NH4OH] = [H+]
[NH4+] = 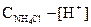 .
.
Так как степень гидролиза мала, то можно считать, что
[H+] << 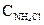
и
[NH4+]» 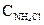
Тогда
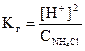 .
.
Используя полученное выражение, находим [H+] и рН раствора:
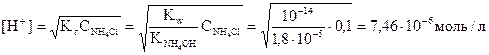
рН = -lg 7,46 10-6 = 5,1
Пример 2. Рассчитать рН 0,1М раствора CH3COONH4.
Ацетат аммония – это соль, образованная катионом слабого основания и анионом слабой кислоты, гидролизуется по катиону и аниону:
CH3COO-+ NH + H2O = CH3COOH + NH4OH
Реакция среды раствора зависит от относительной силы кислоты и основания, образующих соль.
Концентрация ионов Н+ пропорциональна константе кислотности уксусной кислоты:
[H+] ~ Ka.
Концентрация ионов ОН- пропорциональна константе основности гидроксида аммония:
[OH-] ~ Kb.
Тогда
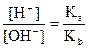
Решим полученное выражение относительно [H+]:
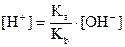 .
.
Умножим обе части уравнения на [H+]:
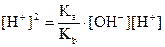
или
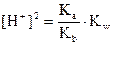
Отсюда
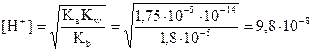
рН = -lg 9,8 10-8 = 7,01
Роль реакций гидролиза в биохимических процессах
В общем случае под гидролизом понимают реакции разложения вещества водой. Гидролизу могут подвергаться соединения различных классов: белки, жиры, углеводы, эфиры, соли.
Роль гидролиза в биохимических процессах трудно переоценить. Прежде всего необходимо отметить ферментативный гидролиз, благодаря которому основные компоненты пищи – белки, жиры и углеводы – расщепляются на более мелкие фрагменты и способны усваиваться организмом.
Особую роль в росте и нормальном функционировании организма играет гидролиз АТФ. Этот процесс является основным источником свободной энергии для осуществления таких эндергонических процессов, как биосинтез белка, ионный транспорт, сокращение мышц, электрической активности нервных клеток.
 2015-05-26
2015-05-26 3800
3800
