Классификация карбоновых кислот
Цикл Кребса
Оптическая изомерия гидроксикарбоновых кислот. Пространственная геометрическая изомерия непредельных кислот. Таутомерия оксо (кето)кислот.
КАРБОНОВЫЕ КИСЛОТЫ И ИХ ГЕТЕРОФУНКЦИОНАЛЬНЫЕ
ПРОИЗВОДНЫЕ: ГИДРОКСИ- И ОКСОКАРБОНОВЫЕ КИСЛОТЫ
Содержание лекции
5.1. Классификация карбоновых кислот
5.2. Строение карбоксильной группы
5.2.1. Значения рКа. карбоновых кислот
5.3. Химические свойства карбоновых кислот
5.4. Характеристика отдельных представителей монокарбоновых кислот. Медико-
биологическое значение
5.5. Непредельные монокарбоновые кислоты
5.6. Дикарбоновые кислоты
5.7. Непредельные ди- и трикарбоновые кислоты
5.8. Гидроксикарбоновые кислоты
5.8.1. Моногидроксимонокарбоновые кислоты
5.8.2. Гидроксидикарбоновые кислоты
5.8.3. Дигидроксидикарбоновые кислоты
5.9. Оксокарбоновые кислоты (альдегидо-, кетокарбоновые кислоты) Значение
величин рКа кислот- субстратов цикла Кребса
5.10 Приложение: происхождение названий монокарбоновых кислот
Исходный уровень знаний для усвоения темы:
Теория Бренстеда-Лоури кислотно-основных свойств биоорганических соединений, классификация кислот и оснований, индуктивный и мезомерный эффекты, влияние заместителей на кислотные и основные свойства, константа кислотности, определение значений рН, рКа, рКв, строение карбоксильной группы, механизм реакции нуклеофильного замещения.
Ключевые слова к теме:
Кислоты монокарбоновые: акриловая, уксусная, муравьиная, пропионовая, масляная, валериановая, пальмитиновая, стеариновая, олеиновая, элаидиновая, линолевая, линоленовая, арахидоновая, кротоновая, сорбиновая.
Кислоты дикарбоновые: щавелевая. малоновая, янтарная, адипиновая, малеиновая, фумаровая.
Гидроксикислоты: гликолевая, молочная. яблочная, 3-гидроксимасляная, лимонная, изолимонная.
Оксокислоты: пировиноградная, щавелевоуксусная, альфа-кетоглутаровая,
ß - оксомасляная (в двух таутомерных формах-енольной и кетоновой).
Среди биологически активных соединений большая роль отводится различным карбоновым кислотам и их производным.
Химическое соединение является карбоновой кислотой, если в его составе есть функциональная карбоксильная группа.
Карбоновые кислоты классифицируют по нескольким признакам состава и строения:
1. по числу карбоксильных групп:
моно-, ди-, трикарбоновые кислоты и т.д.
2. в зависимости от строения радикала:
-алифатические предельные (ациклические, циклические)
- непредельные(содержат одну или несколько кратных связей)
- ароматические (карбо- и гетероароматические)
3. в связи с присутствием в радикале других функциональных групп:
- гидроксикарбоновые(содержат одну или несколько гидроксильных групп)
- оксокарбоновые (содержат карбонильную группу- альдегидную или
кетоновую)
- аминокислоты (содержат одну или несколько аминогрупп).
Активными биоактивными веществами, участниками и метаболитами биохимических реакций, являются все вышеперечисленные представители карбоновых кислот.
О б- О
// //
R – C <===> R – C + Н +
\ \
О – Н б + О –
Карбоновая кислота Карбоксилат - анион
Атомы углерода и кислорода в группе >C = O находятся в состоянии гибридизации
sp2, электронная плотность смещена в сторону атома кислорода. Электронная плотность атома кислорода в гидроксильной группе (неподеленные пары электронов) смещаются в сторону атома углерода, возникает сопряжение, электронная плотность на атоме кислорода в группе –О - Н снижается, увеличивается поляризация связи между атомами кислорода и водорода. На атоме водорода появляется заряд б+ и создаются условия для диссоциации. При удалении протона образуется анион кислоты – карбоксилат анион. В анионе происходит выравнивание длин связей, возникает равномерное распределение электронной плотности между тремя атомами.
O
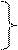 /
/
R — C (-)
\
O
. Низшие карбоновые кислоты в водном растворе меняют окраску индикатора и эти кислоты сильнее угольной кислоты. Данное сравнение весьма важно для понимания биохимических процессов в организме. В крови в условиях слабо щелочной среды кислоты присутствуют в виде натриевых солей, а в тканях в результате обмена веществ непрерывно образуется углекислый газ, который соединяется с водой и образует угольную кислоту.
Н2 О + СО2 = Н2 СО3
Если бы угольная кислота была сильнее органических кислот, она бы вытесняла их из солей и этим нарушала бы кислотно-основное состояние крови(значение рН крови = 7,4)
Донорные заместители в радикале кислоты, как известно, снижают кислотные свойства, а акцепторные заместители - увеличивают. Это правило сохраняет свою справедливость и для карбоновых кислот.
В гомологическом ряду кислотные свойства убывают. В таблице 1 представлены два различных гомологических ряда: насыщенные кислоты- муравьиная, уксусная, пропионовая и дикарбоновые- щавелевая, малоновая, янтарная. Сравните их кислотные свойства и увидите, что в гомологическом ряду они убывают.
Непредельные кислоты сильнее насыщенных (акриловая и пропионовая). Ароматическая бензойная кислота кислоты сильнее алифатической уксусной.
Также дикарбоновые кислоты по первой ступени диссоциации, содержащие до 3 атомов углерода, сильнее муравьиной, а до 5- сильнее уксусной. При более длинной цепи влияние групп становится незаметным.
Сравните величины рКа некоторых карбоновых кислот(таблица 1):
5.2.1. Значение величин рКа некоторых карбоновых кислот:
Таблица1
| Кислота(название, формула) | Значение рК а | Кислота(название, формула) | Значение рК а |
| НСООН муравьиная | 3, 77 | СН =СН-СООН пропеновая (акриловая) | 4,25 |
| СН3 СООН уксусная | 4, 76 | С 6 Н 5 СООН бензойная | 4, 17 |
| СН 3СН2СООН пропионовая | 4, 88 | НООС-СООН щавелевая | 1, 23 |
| СН2 F СООН фторуксусная | 2, 66 | НООС-СН2-СООН малоновая | 2, 83 |
| СН2 С1СООН хлоруксусная | 2, 86 | НООС-СН2-СН2-СООН янтарная | 4, 21 |
| СН3 СН(ОН)СООН молочная | 3.97 | СН3-СН=СН-СООН кротоновая | 4,70 |
 2014-01-31
2014-01-31 903
903








