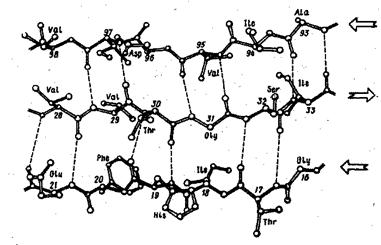
Третичная структура белка – это расположение полипептидной цепи вместе со спиральными участками в пространстве.
Белки можно разделить на два основных класса:
1. фибриллярные белки имеют расположенные параллельно друг другу вытянутые полипептидные цепи, образующие длинные нити или слои, например, фиброин шелка, коллаген – основной компонент соединительной ткани;
2. глобулярные белки, в которых полипептидные цепи плотно свернуты в компактные структуры сферической формы- глобулы.
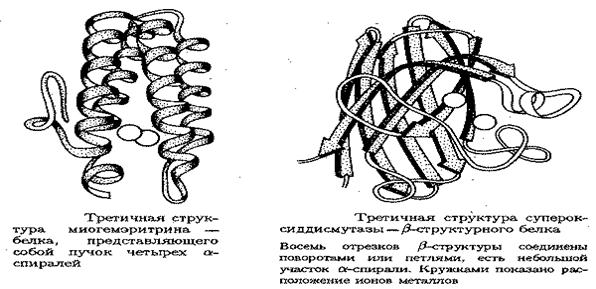
С появлением третичной структуры, у белка появляются и новые свойства- биологические. В частности, проявление каталитических свойств связанно именно с наличием у белка третичной структуры. И наоборот, нагревание белков, приводящее к разрушению третичной структуры (иначе известно как денатурация) одновременно приводит и к утрате биологических свойств.
Силы, стабилизирующие третичную структуру глобулярных белков:
1. водородные связи между R- группами остатков аминокислот, расположенных в соседних петлях полипептидной цепи;
2. электростатическое притяжение между противоположно заряженными R- группами аминокислот;
3. гидрофобные взаимодействия. Гидрофобные R- группы некоторых аминокислотных остатков избегают контактов с водным кружением и стремятся собраться вместе внутри глобулярной структуры, где они защищены от соприкосновения с водой;
4. ковалентные поперечные связи. Соседние петли полипептидной цепи в некоторых белках содержат остатки цистеина, которые образуют внутрицепочечные ковалентные поперечные связи между соседними петлями (дисульфидные поперечные связи - S - S -). Такие связи намного прочнее, чем перечисленные выше нековалентные взаимодействия, однако они встречаются не во всех белках.
Информация, определяющая третичную структуру белков, заложена в аминокислотной последовательности их полипептидных цепей, о чем свидетельствует тот факт, что гомологичные белки из разных видов имеют не только сходный аминокислотный состав, но и одинаковую конформацию.
Четвертичная структура белка. Большинство глобулярных белков – это олигомерные белки, содержащие 2 и более полипептидные цепи. Способ расположения в пространстве отдельных полипептидных цепей олигомерного белка называют четвертичной структурой этого белка.
Четвертичная структура белка подразумевает такое объединение белков третичной структуры, при котором появляются НОВЫЕ биологические свойства, не характерные для белка в третичной структуре. В частности, такие эффекты, как КООПЕРАТИВНЫЙ и АЛЛОСТЕРИЧЕСКИЙ, очень часто характерны лишь для белков четвертичной структуры. Каждый из белков-участников третичной структуры при образовании четвертичной структуры называют СУБЪЕДИНИЦЕЙ или ПРОТОМЕРОМ. В образовании четвертичной структуры белка принимают участие те же связи, что и при образовании третичной структуры, за исключением ковалентных.
Четвертичная структура ферритина (ММ= 440 kDa) состоит из 24 субъединиц (протомеров) 18,5 kDa каждая. Частичная денатурация ферритина вызывает появление агрегатов массой 220 kDa
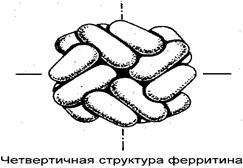
Объединение белковых молекул третичной структуры без появления НОВЫХ биологических свойств называют АГРЕГИРОВАННЫМ состоянием. Как четвертичная структура, так и агрегированное состояние могут быть обратимо разрушены с применением детергентов, в частности, ДОДЕЦИЛСУЛЬФОНАТА НАТРИЯ или неионных детергентов типа ТРИТОНА. Очень часто для разрушения четвертичной структуры исследуемый белок нагревают при 100 С в присутствии 1% 2-меркаптоэтанола и 2% додецилсульфоната натрия (SDS). В таких условиях восстанавливаются дисульфидные связи между остатками цистеина, которые в некоторых случаях удерживают субъединицы четвертичной структуры.
Биологический смысл появления четвертичной структуры у белков- экономия “генетического материала”, поскольку каждая из субъединиц кодируется только одним геном ДНК. К тому же, в случае появления ошибки при трансляции у одной из субъединиц, отпадает необходимость РЕСИНТЕЗА остальных субъединиц. Четвертичная структура в таком случае распадается на субъединицы, дефектная субъединица удаляется и вновь образуется четвертичная структура с участием нормальной субъединицы. В конце концов, появление ошибки менее вероятно при синтезе (трансляции) сравнительно небольшой полипептидной цепи.
Практически все белки-ферменты имеют четвертичную структуру и состоят, как правило, из четного числа протомеров (двух, четырех, шести, восьми).
 2014-01-31
2014-01-31 896
896








