Основные поступления неорганических соединений серы в тропосферу связаны с антропогенными источниками. На их долю приходится примерно 65% всех поступлений неорганических соединений серы в атмосферу. Около 95% из этого количества составляет SO2.
Из природных источников поступления неорганических соединений серы следует выделить волновую деятельность в океанах, приводящую к образованию аэрозолей MgSO4 и CaSO4. Они составляют примерно 30% поступления серы в виде неорганических соединений в атмосферу.
Биологические источники неорганических соединений серы выделяют преимущественно Н2S, с которым в атмосферу по разным оценкам поступает от 23 до 49% всех неорганических соединений серы. Масштабы поступления Н2S в атмосферу и процессы его трансформации в атмосфере изучены еще недостаточно подробно. Имеющиеся в литературе сведения позволяют лишь грубо оценить его содержание в тропосфере. Так, над океаном концентрация Н2 S колеблется от 0,0076 до 0,076 мкг·м-3, а над континентами – от 0,05 до 0,1 мкг·м-3. Принимая во внимание скорость поступления сероводорода в атмосферу и его содержание в тропосфере, можно оценить время его жизни в атмосфере в несколько часов.
Сероводород последовательно окисляется в SO2 при участии свободных радикалов. Детальный механизм этого процесса еще не установлен. Наиболее вероятным представляется протекание следующих реакций:
Н2S + •OH → H2O + HS• (56)
HS• + O2 → SO2 + •OH (57)
SO + HO2• → SO2 + •OH (58)
Полученный в результате диоксид серы, как и SО2, поступающий из других источников, окисляется далее. Механизм этого процесса изучен более подробно.
Окисление SО2 может протекать в газовой фазе, в твердой фазе и в жидкой фазе.
Газофазное окисление (первый путь) исторически является первой попыткой объяснить процессы окисления SО2 в атмосфере. Долгие годы основной механизм процесса связывали с образованием SО2 в возбужденном состоянии, который, реагируя с О2, образует SО3:
SО2 + hν → SO2* 290 нм < λ< 400 нм (59)
SO2* + 2О2 → SO3 + O3 (60)
или с реакцией с участием третьего тела:
SO2* + О2 + М → SO4 + М* (61)
SO4 + O2 → SO3 + O3 (62)
Образующийся SO3 вступает во взаимодействие с молекулами воды:
SO3 + H2O → H2SO4 (63)
Однако, как показали исследования последних десятилетий, рассмотренный механизм является возможны,. но не основным процессом окисления SO2 в газовой фазе.
Лабораторные эксперименты показали, что скорость изменения концентрации SO2 в фотохимических камерах, содержащих очищенный воздух, описывается кинетическим уравнением первого порядка. Значение константы скорости процесса составляет 10-3ч-1. Квантовый выход реакции изменяется от 10-3 до 5·10-3.
Процесс окисления SO2 в фотохимических камерах значительно ускоряется, если в воздухе содержатся оксиды азота или углеводороды. В этом случае становится возможным протекание процесса с участием атомарного кислорода и свободных радикалов. Атомарный кислород окисляет молекулу SO2 при участии третьего тела:
SO2 + O + M → SO3 + M* (64)
Принимая во внимание экспериментально найденное значение константы скорости этого процесса и концентрацию атомарного кислорода и третьего тела в атмосфере, можно утверждать, что этот процесс следует учитывать только на высоте более 10 км при концентрацииSO2, равной 1 мкг·м-3. Время пребывания SO2 на высоте 10 км при отсутствии других процессов должно составлять примерно 1000 часов и должно уменьшаться на высоте 30 км до 5-10 часов.
Из того, что время жизни SO2 в приземном слое воздуха значительно отличается от расчетных значений – по реакции (64), следует, что реакция окисления SO2 атмосферным кислородом не играет существенной роли в трансформации соединений серы в тропосфере; ведущую роль играют свободные радикалы. Протекающие при этом процессы можно представить следующими уравнениями реакций:
SO2 + •OH + M → HSO3 + M* (65)
HSO3 + HO2•→ SO3 + 2 •OH (66)
SO2 + HO2• → SO3 + •OH (67)
SO2 + CH3O2• → SO3 + CH3O• (68)
Скорость трансформации SO2 в воздухе, имеющем средние для тропосферы значения концентрации свободных радикалов, составляет примерно 0,1 %·час-1, что соответствует времени пребывания в тропосфере, равному 5 суткам. Процесс трансформации SO2 резко ускоряется в воздухе промышленных регионов, где увеличивается содержание свободных радикалов. Скорость процесса может возрастать до 1%·час-1.
SО3 образует растворы серной кислоты, которая частично превращается в сульфаты аммония, натрия, кальция. Образование сульфатов происходит на поверхности твердых частиц, присутствующих в воздухе. В этом случае стадии окисления предшествует адсорбция, часто сопровождающаяся химической реакцией (второй путь окисления SO2):
SO2 + CaO → CaSO3 или (69)
SO2 + MgO → MgSO3, далее (70)
2CaSO3 + O2 → 2CaSO4 или (71)
2MgSO3 + O2 → 2MgSO4. (72)
Оксиды железа, алюминия, хрома и других металлов, которые также могут находиться в воздухе, резко ускоряют процесс окисления SO2. В присутствии, например, частиц Fe2O3 скорость процессов трансформации SO2 составляет примерно 100 %час-1. Необходимо отметить, однако, что данное значение получено для воздуха, в котором содержание Fe2O3 в 100-200 раз превышало фоновые концентрации. Поэтому данный процесс трансформации диоксида серы играет основную роль лишь в сильно запыленном воздухе, содержащем значительные количества оксидов металла.
Третий путь окисления SO2 в тропосфере связан с предварительной абсорбцией SO2 каплями атмосферной влаги. В дождливую погоду и при высокой влажности атмосферы этот путь окисления может стать основным в процессе трансформации SO2. В качестве окислителя в природных условиях часто выступает H2O2. При высоких значениях рН, когда в растворе в основном присутствуют ионы SO32-, скорость окисления заметно возрастает:
А: SO32-+ 2ОН- -2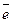 → SO42- + Н2О φº=-0,93 В
→ SO42- + Н2О φº=-0,93 В
К: Н2О2 + 2Н+ +2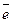 → 2Н2О φº=1,77 В
→ 2Н2О φº=1,77 В
SO32- + Н2О2 → SO42- + Н2О
 2014-01-31
2014-01-31 1000
1000








