Фотохимический смог вызывает у людей сильное раздражение слизистой обо лочки дыхательных путей и глаз, губит листву на деревьях;
Химически он действует как окислитель (усиливает коррозию металлов, приво дит к растрескиванию резины и т. д.);
Фотохимический смог образуется в ясную солнечную погоду при низкой влаж ности воздуха, причем максимальная концентрация вызывающих раздражение органов чувств веществ наблюдается вскоре после полудня;
ФОТОХИМИЧЕСКИЙ СМОГ В ГОРОДСКОЙ АТМОСФЕРЕ
В настоящее время различают два основных вида смога: смог, связанный с загрязнением атмосферы копотью или дымом, содержащим SО2 (лондонский смог), и смог, вызванный загрязнением воздуха выхлопными газами транспорта, содержащими оксиды азота (смог Лос-Анджелеса). Для второго типа смога необходимой составной частью процесса его образования является протекание химических реакций, поэтому его часто называют фотохимическим смогом.
Среди особенностей фотохимического смога необходимо выделить следующие:
|
|
|
Соединениями, ответственными за ряд перечисленных свойств смога, в первую очередь, являются озон и пероксиацетилнитрат (ПАН).
Как показывают экспериментальные данные, увеличение концентрации озона в пробах воздуха, содержащих разбавленные выхлопные газы автомобилей, связано с характерными изменениями относительного содержания оксидов азота (рис.12).
Рост концентрации О3 в пробах воздуха начинается после того, как соотношение СNO2: CNO достигает максимума. Изменение концентрации озона в загрязненной городской атмосфере связано с процессами превращения оксидов азота.
Образование озона происходит в 2 стадии, первая из которых лимитирует скорость всего процесса:
NO2 + hν → NO + O(3P) (I39 =7,2·10-3c-1) (39)
О(3Р) + О2 + М → О3 + М*
Одним из главных химических стоков О3 в тропосфере служит его реакция с NO
О3 + NО → О2 + NО2 (κ38=1,8·10-14 см3/(молек.·с)) (38)
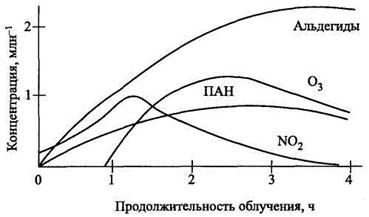
Рис. 12 – Изменение концентраций примесей в атмосфере при облучении выхлопных газов автомобилей
Скорости реакций лимитирующих стадий описываются уравнениями:
υ39 = I39·CNO2
υ38 = κ38·CO3·CNO
В стационарных условиях υ39 = υ38, поэтому
I39·CNO2 = κ38·CO3·CNO и
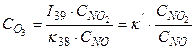 (45)
(45)
Подставив в (45) значения I39 и κ38 и типичное для воздуха городов отношение СNO2:CNO = 0,3, получим концентрацию озона 1,2·1011см-3, или около 5 млрд-1. Она гораздо ниже, чем наблюдаемая даже в воздухе фоновых районов. Однако концентрация О3 будет возрастать при увеличении скорости конверсии NO в NO2. Такое ускорение может быть вызвано пероксильными радикалами:
NO + HO2• → NO2 + HO• (37)
NO + RO2• → NO2 + RO• (46)
Эти радикалы образуются при окислени СО:
СО + НО• → СО2 + Н (17)
|
|
|
Н• + О2 + М → НО2• + М* (47), а также при окислении углеводородов, например метана:
СН4 + НО• → СН3• + Н2О (18)
СН3• + О2 + М → СН3О2• + М* (48)
Окисление метана в «чистом» воздухе приводит к образованию формальдегида (процесс включает 6 стадий):
СН4 + О2 → СН2О + Н2О (49)
В присутствии NО общий результат окисления метана сильно изменяется (процесс включает 13 стадий):
СН4 + 8О2 + 4М → СО2 + 2Н2О + 4М* + 4О3 (50)
Этот процесс приводит к накоплению О3.
С присутствием органических соединений в воздухе городов связаны и процессы образования высокотоксичных пероксидных соединений, таких как ПАН.
При окислении предельных углеводородов могут образовываться альдегиды (49), которые окисляются далее:
RCH=O + HO• → RC•=O + H2O (51)
RC•=O + O2 → RC(O)OO• (52)
Ацилпероксидный радикал окисляет монооксид азота, образует надкислоту при столкновении с НО2• или присоединяет NО2:
RC(O)O2• + NO → RC(O)O• + NO2 (53)
RC(O)O2• + HO2• → RC(O)OH + O2 (54)
RC(O)O2• + NO2→ RC(O)OONO2 (55)
Последняя реакция приводит к пероксиацилнитратам, например,
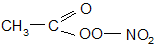 или
или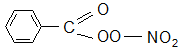
 2014-01-31
2014-01-31 760
760








