В 1869 г. Д. И. Менделеев сообщил об открытии периодического закона, современная формулировка которого такова: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра атомов и определяются периодически повторяющимися однотипными электронными конфигурациями их атомов. Наглядным выражением закона служит периодическая система Д. И. Менделеева.
Периодическая система состоит из периодов и групп. Периодом называется последовательный ряд элементов, расположенных в порядке возрастания заряда ядра их атомов, электронная конфигурация которых изменяется от ns1 до ns2np6 (или до ns2 у первого периода).
По горизонтали в периодической системе расположено 7 периодов, из которых три малых (1-3) и четыре больших (4-7). Начало каждого периода сопровождается образованием нового энергетического уровня. Любой период начинаются щелочным металлом (… ns1) и заканчивается благородным газом (… ns2np6 или ns2 у первого периода). Металлические свойства рассматриваются, как способность атомов элемента легко отдавать электроны (восстановительные свойства), а неметаллические – присоединять электроны (окислительные свойства). В периодах с возрастанием порядкового номера элемента усиливаются неметаллические и окислительные свойства, а металлические и восстановительные ослабевают. Этосвязано с тем, что число энергетических уровней у элементов одного и того же периода не изменяется, а заряд ядра возрастает, и связь электронов с ядром усиливается.
Усиление неметаллических свойств в пределах данного периода иллюстрируется изменением характера оксидов и гидроксидов, образуемых элементами этого периода. В периодах при переходе слева направо происходит усиление кислотных и ослабление основных свойств высших оксидов и соответствующих им гидроксидов.
По вертикали в таблице расположено 8 групп, что соответствует максимальному числу электронов на внешних энергетических уровнях. Группы делятся на подгруппы – главные и побочные. Подгруппы включают в себя элементы с аналогичными электронными структурами и, следовательно, сходными свойствами (элементы-аналоги). В главных (А) подгруппах расположены s -элементы (I, II группы) и p -элементы (III-VIII группы). В атомах элементов главных подгрупп валентные электроны находятся на s - и р -подуровнях внешнего энергетического уровня и общее их число равно номеру группы. В главных подгруппах при переходе сверху вниз усиливаются металлические свойства, основной характер соединений и их устойчивость в низшей степени окисления. Например, для элементов IV А-группы возможные степени окисления +2 и +4. Для углерода наиболее характерна степень окисления +4, поэтому четырехвалентные соединения углерода устойчивы и не проявляют окислительных свойств. У свинца металлические свойства выражены сильнее, чем у углерода и для него характерна степень окисления +2, вследствие чего соединения свинца со степенью окисления +4 являются окислителями.
В побочных (В) подгруппах располагаются d- и f- элементы. Валентные электроны в атомах d- элементов находятся на s- подуровне внешнего и d- подуровне предвнешнего энергетических уровней и их максимальное число равно номеру группы. В побочных подгруппах, кроме подгруппы скандия, при переходе сверху вниз усиливаются неметаллические свойства, кислотный характер соединений и их устойчивость
d- элементы побочных подгрупп склонны проявлять переменную степень окисления. Характер образуемых ими соединений зависит от степени окисления элемента. Соединения, в которых элемент находится в низшей степени окисления, имеют основной характер, в высшей степени окисления – кислотный, в промежуточной – амфотерный. Например, хром проявляет степени окисления +2, +3, +6 и характер образуемых им оксидов следующий:
Cr+2O 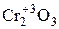 Cr+6O3
Cr+6O3
основной амфотерный кислотный
Элементы главных и побочных подгрупп сильно отличаются по своим свойствам. Общими для элементов главных и побочных подгрупп являются формулы высших оксидов и их гидроксидов. У высших оксидов и соответствующих им гидроксидов элементов I–III групп (кроме бора) преобладают основные свойства, IV–VII групп – кислотные.
| Группа | I | II | III | IV | V | VI | VII | |
| Формула высшего оксида | 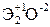
| 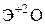
| 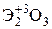
| 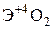
| 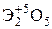
| 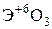
| 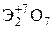
| |
| Формула гидроксида | ЭОН | Э(ОН)2 | Э(ОН)3 | Н2ЭО3 | НЭО3 | Н2ЭО4 | НЭО4 | |
| Основания | Кислоты | |||||||
 2014-01-31
2014-01-31 795
795








