Все галогены (кроме фтора и астата) получают в промышленных масштабах.
Фтор получают электролизом безводной (т.к. фтор реагирует с водой) HF в расплаве гидрофторида калия KHF2:
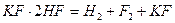 ,
,
или термолизом:
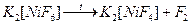 ,
,
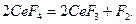
Хлор в лаборатории получают окислением концентрированной соляной кислоты:
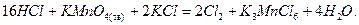
В промыш ленности – электролизом раствора хлорида натрия:
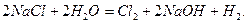
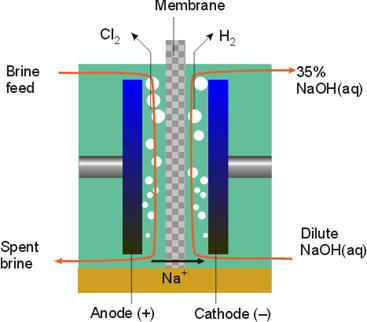
Есть 2 способа осуществления электролиза – диафрагменный и мембранный.
Мембранный метод производства хлора наиболее энергоэффективен, однако сложен в организации и эксплуатации.
В современных электролизёрах катодное и анодное пространства разделены полимерной анионообменной мембраной. Мембрана позволяет катионам Na+ переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl− в Cl2) и накапливаются у катода (образование OH−). Перемещение OH− в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH− реагировал бы с Cl2 и сводил на нет весь результат.
В анодное пространство поступает поток раствора соли, а в катодное — деионизированная вода. Из катодного пространства вытекает поток обедненного анолита, содержащего так же примеси гипохлорит- и хлорат-ионов и выходит хлор, а из анодного — щелочи и водород, практически не содержащие примесей и близкие к товарной концентрации, что уменьшает затраты энергии на их упаривание и очистку.
Питающий раствор соли (как свежий, так и оборотный) и вода предварительно максимально очищается от любых примесей. Такая тщательная очистка определяется высокой стоимость полимерных катионообменных мембран и их уязвимость к примесям в питающем растворе.
В промышленности бром и йод добывают хлорированием морской воды (также воды некоторых соленых озер):
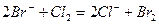 ,
,
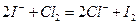
в лаборатории (редко) получают, окисляя хлориды и бромиды:
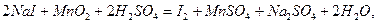
или вытеснением хлором из солей:
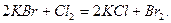
Химические свойства галогенов
Фтор химически чрезвычайно активен, он сильнейший окислитель. В атмосфере фтора горят даже стекло и вода, асбест и кирпич:
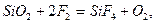
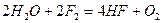 .
.
Одним из продуктов горения является кислород, т.е. фтор является более сильным окислителем, чем кислород.
Фтор окисляет «благородные» газы:
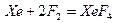 .
.
Хлор также сильный окислитель, восстановительные свойства проявляет лишь с фтором. Может диспропорционировать:
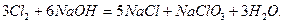
Взаимодействие галогенов с простыми веществами:
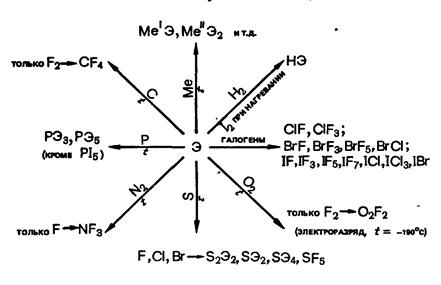
Взаимодействие галогеном с важнейшими реагентами:
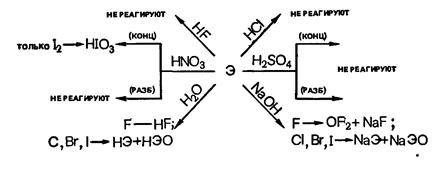
Бром и хлор, растворяются в воде, и, частично реагируя с ней, образуют так называемую «хлорную воду» и «бромную воду».
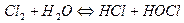
Йод практически в воде не растворим и не способен ее окислять даже при нагревании; по этой причине не существует «йодной воды».
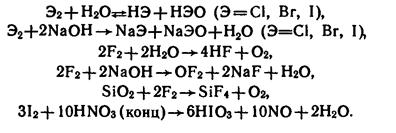
Галогеноводороды.
Галогеноводороды HHal – газы (кроме HF), хорошо растворимы в воде.
Общая характеристика галогеноводородов:
| Водородные соединения | HF | HCl | HBr | HI |
| Внешний вид при н.у. | Бесцв. дымящая жидкость | Бесцветные газы | ||
| Тпл, oC | -83 | -114,2 | -86,9 | -50,8 |
| Ткип, oC | 19,52 | -85,08 | -66,8 | -35,4 |
| Длина связи Э-Н, пм | ||||
| Энергия связи ЭН, кДж/моль | ||||
| КА | 7,2∙10-4 | 107 | 109 | 1,6∙1011 |
| Растворимость в воде, л HЭ/л воды | ∞ | |||
| μ, D | 1,83 | 1,11 | 0,83 | 0,45 |
В ряду HF-HCl-HBr-HI прочность связи Н-Э уменьшается, сила кислот увеличивается, восстановительная способность увеличивается.
В ряду HF-HCl-HBr-HI дипольный момент уменьшается, но поляризуемость молекул увеличивается, поэтому температуры плавления и кипения повышаются.
Молекула HF сильно полярна (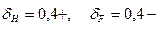 ), образует ассоциаты за счет водородный связей. Поэтому HF в отличие от других галогеноводородов является жидкостью. Даже в газообразном состоянии HF состоит из полимеров (HF)n, n=2-6.
), образует ассоциаты за счет водородный связей. Поэтому HF в отличие от других галогеноводородов является жидкостью. Даже в газообразном состоянии HF состоит из полимеров (HF)n, n=2-6.
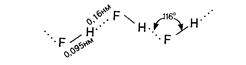
Из-за сильного межмолекулярного взаимодействия молекула HF диссоциирует по схеме:
H-F∙∙∙H-F∙∙∙H-F ↔ [H-F-H]+ + [F-H-F]-
↔ [H-F-H]+ + [F-H-F]-
или H-F∙∙∙H-F∙∙∙H-F ↔ 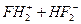
фтороний-ион фторогидрогенат-ион
Способы получения галогеноводоров:
HF получают из плавикового шпата действием концентрированной серной кислоты:
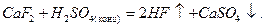
HCl в промышленности получают синтезом из простых веществ:
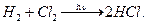
В лаборатории HCl получают из хлоридов:
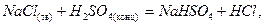
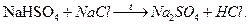
HBr получают по реакции:
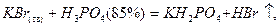
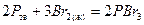 ,
,
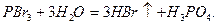
HI получают гидролизом иодида фосфора PI3 и по реакции:
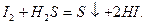
При взаимодействии HF c щелочами образуются дифториды:
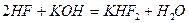 .
.
Фтороводород и плавиковая кислота разрушают кварц и стекло:
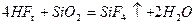 ,
,
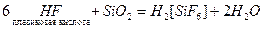 .
.
Жидкий фтороводород является хорошим растворителем, растворяет воду, фториды, сульфаты и нитраты s-элементов I группы и чуть хуже s-элементы II группы.
- сильные кислоты (кроме HF, она является сильной только в чистом виде)
HF-HCl-HBr-HI
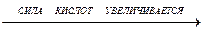
Значения степеней диссоциации α в 0,1М растворах кислот при 18 оС:
| HF | HCl | HBr | HI |
| 10% | 92,6% | 93,5% | 95% |
- восстановители (кроме HF):
HF-HCl-HBr-HI
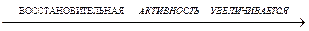
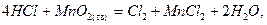
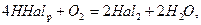 Сl2 при нагревании
Сl2 при нагревании
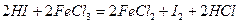 ,
,
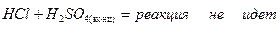 ,
,
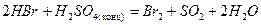 ,
,
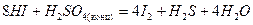 .
.
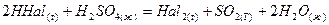
HF HCl HBr HI
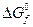 , кДж/моль 460 105 25 -68
, кДж/моль 460 105 25 -68
| HF(г) | HCl(г) | HBr(г) | HI(г) | F2(г) | Cl2(г) | Br2(г) | I2(г) | SO2(г) | H2SO4(ж) | H2O(ж) | |
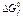 , кДж/моль , кДж/моль | -275,41 | -95,3 | -53,43 | 1,58 | 19,39 | -300,2 | -690,14 | -237,24 |
 2014-01-31
2014-01-31 1421
1421








