Водород
Лекция №1
Строение и функции АТФ
Аденозинтрифосфорная кислота (АТФ) — универсальный источник и основной аккумулятор энергии в живых клетках. АТФ содержится во всех клетках растений и животных. Количество АТФ в среднем составляет 0,04% (от сырой массы клетки), наибольшее количество АТФ (0,2–0,5%) содержится в скелетных мышцах.
АТФ состоит из остатков: 1) азотистого основания (аденина), 2) моносахарида (рибозы), 3) трех фосфорных кислот. Поскольку АТФ содержит не один, а три остатка фосфорной кислоты, она относится к рибонуклеозидтрифосфатам.
Для большинства видов работ, происходящих в клетках, используется энергия гидролиза АТФ. При этом при отщеплении концевого остатка фосфорной кислоты АТФ переходит в АДФ (аденозиндифосфорную кислоту), при отщеплении второго остатка фосфорной кислоты — в АМФ (аденозинмонофосфорную кислоту). Выход свободной энергии при отщеплении как концевого, так и второго остатков фосфорной кислоты составляет по 30,6 кДж. Отщепление третьей фосфатной группы сопровождается выделением только 13,8 кДж. Связи между концевым и вторым, вторым и первым остатками фосфорной кислоты называются макроэргическими (высокоэнергетическими).
Запасы АТФ постоянно пополняются. В клетках всех организмов синтез АТФ происходит в процессе фосфорилирования, т.е. присоединения фосфорной кислоты к АДФ. Фосфорилирование происходит с разной интенсивностью при дыхании (митохондрии), гликолизе (цитоплазма), фотосинтезе (хлоропласты).
АТФ является основным связующим звеном между процессами, сопровождающимися выделением и накоплением энергии, и процессами, протекающими с затратами энергии. Кроме этого, АТФ наряду с другими рибонуклеозидтрифосфатами (ГТФ, ЦТФ, УТФ) является субстратом для синтеза РНК.
План лекции
1. Положение водорода в периодической системе;
2. Изотопы водорода;
3. Нахождение в природе и методы получения;
4. Физические свойства;
5. Химические свойства;
6. Соединения водорода – гидриды;
7. Применение водорода.
Водород занимает особое положение в периодической системе элементов Д.И. Менделеева.
Водород проявляет сходство с щелочными металлами, поэтому его условно помещают в I группу главную подгруппу:
1. Щелочные металлы и водород имеют одинаковое строение внешнего энергетического уровня. Электронная конфигурация валентных электронов ns1, валентный электрон находится на s-подуровне внешнего энергетического уровня;
2. Сходство атомных спектров щелочных металлов и водорода (спектры испускания и поглощения состоят из небольшого набора линий);
3. Водород является восстановителем, отдавая один электрон, проявляет степень окисления +1, характерную и для щелочных металлов.
Водород не помещают с полным правом в I группу главную подгруппу, потому что:
1. Водород может проявлять не только восстановительные свойства, но и окислительные свойства.
2. Щелочные металлы имеют металлические кристаллические решетки, а водород молекулярную кристаллическую решетку. Молекула водорода двухатомна.
3. Соединения водорода со степенью окисления +1 не имеют сходства с соединениями щелочных металлов со степенью окисления +1.
4. Ионы щелочных металлов существуют в расплавах и кристаллических решетках, а ион водорода 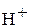 не обнаружен.
не обнаружен.
5. Энергия ионизации атома водорода (1312 кДж/моль) больше энергии ионизации атомов щелочных металлов (для атома натрия 495,8 кДж/моль).
Водород проявляет сходство с галогенами, поэтому его условно помещают в VII группу главную подгруппу:
1. Водород является окислителем, отдавая один электрон, проявляет степень окисления – 1, характерную и для галогенов;
2. Соединения водорода со степенью окисления – 1 имеют сходства с соединениями щелочных металлов со степенью окисления –1. Например, NaH – твердое кристаллическое вещество, с кристаллической решеткой близкой к ионному типу; NaCl – твердое кристаллическое вещество с ионной кристаллической решеткой.
3. При обычных условиях водород и галогены существуют в газообразном состоянии, их молекулы двухатомны (Н2, F2, Cl2, Br2, J2).
4. Близкие значения энергии ионизации атома водорода (1312 кДж/моль) и атомов галогенов (для атома хлора 1255 кДж/моль);
Водород не помещают с полным правом в VII группу главную подгруппу, потому что:
1. В VII группе главной подгруппе окислительные свойства уменьшаются, а восстановительные свойства увеличиваются:
| Н | F | Cl | Br | |
| Eи, кДж/моль |
У атома водорода значение энергии ионизации должно быть больше, чем у атома фтора.
2. Фтор – сильный окислитель, водород – преимущественно восстановитель, слабый окислитель.
Американский химик Томас Купер – сходство углеродом (аналог углерода), поэтому водород условно можно поместить в IV группу главную подгруппу:
1. Близкие значения энергии ионизации атома водорода (1312 кДж/моль) и атома углерода (для атома углерода 1086 кДж/моль);
2. Водород и углерод имеют сходство в строении внешнего энергетического уровня, а именно обладают наполовину заполненным внешним энергетическим уровнем.
3. Водород и углерод соединяются с большинством элементов периодической системы.
4. Водород и углерод образуют преимущественно ковалентные связи.
5. Соединения углерода и водорода наиболее распространены в природе.
Карапетьянц Михаил Христофорович – водород условно можно разместить над атомом бора в III группе главной подгруппе на основании того, что многие термодинамические свойства водорода и его соединений хорошо вписываются в III группу главную подгруппу (сходство между H2O и В2О3).
Вывод: водород занимает место во всех группах – это уникальный элемент, который отражает свойства всех элементов. Недаром в первом варианте Периодической системы в 1869 году Д.И. Менделеев выделил водород в особую графу.
Прим. Несмотря на высокую распространенность, водород открыли только в первой половине XVI в. Роберт Бойль и его современники наблюдали выделение газа при взаимодействии некоторых металлов с кислотами. Столетия спустя Генри Кавендиш, который подробно изучил свойства «горючего воздуха», как тогда называли водород. Откуда же произошло название водород. Дал это название элементу Лавуазье, который занимался в 1779 г. исследованием состава воды путем ее синтеза и разложения. По предложению А. Лавуазье новый элемент был назван «водородом» (Hydrogenium) – «рождающий воду».
 2014-01-31
2014-01-31 827
827








