Водород образует три изотопа с массовыми числами 1, 2, 3:
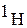 – протий;
– протий;
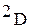 (
(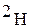 ) – дейтерий;
) – дейтерий;
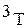 (
(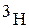 ) – тритий.
) – тритий.
В природе водород находится в виде протия 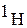 (99,98%). 0,0156% природного водорода приходится на долю «тяжелого» водорода – дейтерия, масса которого вдвое больше массы протия. Протий и дейтерий не являются радиоактивными.
(99,98%). 0,0156% природного водорода приходится на долю «тяжелого» водорода – дейтерия, масса которого вдвое больше массы протия. Протий и дейтерий не являются радиоактивными.
Впервые дейтерий был получен в виде тяжелой воды D2O путем электролиза природной воды.
Тяжелая вода D2O – вода, образованная атомами дейтерия. По своим физико-химическим свойствам отличается от Н2О:
| Н2О | D2O | |
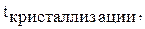 °С °С | 3,83 | |
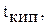 °С °С | 101,42 | |
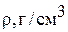 | 1 (при 20 ºС) | 1,1053 (при 20 ºС) |
В настоящее время дейтерий получают из природной смеси путем изотопного обмена между водой и сероводородом: 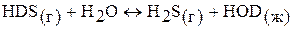 . Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
. Для получения 1 л тяжелой воды требуется 41 т воды и 135 т сероводорода.
Химические реакции в тяжелой воде протекают медленнее, по сравнению с обычной водой, водородные связи с участием дейтерия несколько сильнее обычных. Тяжёлая вода токсична. Тяжелая вода оказывает губительное действие на животных и человека. Например, замена 1/3 Н2О на D2O приводит к бесплодию, нарушению углеводного баланса и анемии.
Однако некоторые микроорганизмы способны жить в 70%-ной тяжёлой воде (простейшие) и даже в чистой тяжёлой воде (бактерии). Человек может без видимого вреда для здоровья выпить стакан тяжёлой воды, весь дейтерий будет выведен из организма через несколько дней. В этом отношении тяжёлая вода менее токсична, чем, например, поваренная соль.
Тяжелая вода является промышленным продуктом и доступна в больших количествах. Производство тяжёлой воды очень энергоёмко, поэтому её стоимость довольно высока (ориентировочно 200 – 250 долларов за кг).
Ядра дейтерия имеют спин ядра равный 1, с этим связано использование тяжелой воды и других дейтерированных растворителей (дейтерохлороформ CDCl3) в спектроскопии ядерного магнитного резонанса. Тяжелая вода находит применение в ядерной технике в качестве замедлителя быстрых нейтронов, поскольку она быстро понижет энергию нейтронов ядерного деления, а также вследствие того, что дейтерий имеет низкое сечение захвата нейтронов (не поглощает нейтроны), чем водород, и, следовательно, заметно уменьшает нейтронный поток.
Дейтерий широко применяют при изучении механизмов реакции и при кинетических исследованиях.
От других изотопов тритий отличается тем, что он радиоактивен. В природе тритий встречается в очень малых количествах. Естественное содержание трития – 1 атом на 1018 атомов водорода, это результат ядерных реакций, протекающих вод действием космических лучей в верхних слоях атмосферы:
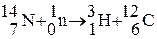
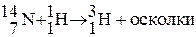
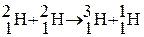
После испытаний термоядерного оружия (1954 г.) концентрация трития увеличилась в сотни раз, но в настоящее время она упала в результате запрета на испытания ядерного оружия в атмосфере. Низкое содержание трития в земной коре объясняется и его радиоактивностью с периодом полураспада 12,35 года 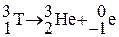 . В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
. В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
В настоящее время тритий получают в ядерных реакторах при облучении лития нейтронами: 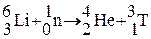 .
.
Литий используют в виде сплава с магнием или алюминием, который удерживает в себе много трития, который освобождается при растворении облученного сплава в кислоте.
Прим. Наиболее удобный способ хранения трития состоит в превращении его в UT3 по реакции с мелко раздробленным ураном. Из данного соединения тритий легко освобождается при нагревании выше 400 ºС.
Тяжелая вода на основе трития T2O обладает сильной радиоактивностью. Поэтому обычно используют разбавленные растворы, содержащие 1% тритиевой воды. Тритий является чистым β-излучателем без примеси γ-компоненты, поэтому он относительно безопасен, так как β-частицы обладают низкой проникающей способностью, поэтому задерживаются листом бумаги или слоем воздуха в 3 мм. Тритий – один из наименее токсичных радиоизотопов.
Тритий может служить радиоактивной меткой для изучения различных природных процессов. Анализ атмосферного трития дает ценную информацию о космических лучах. А тритий в осадочных породах может свидетельствовать о перемещениях воздуха и влаги на Земле.
Наиболее богатые природные источники трития – дождь и снег, поскольку почти весь тритий, образующийся под действием космических лучей в атмосфере, переходит в воду. Интенсивность космической радиации изменяется с широтой, поэтому осадки, например, в средней полосе России несут в несколько раз больше трития, чем тропические ливни. И совсем мало трития в дождях, которые идут над океаном, поскольку их источник – в основном та же океаническая вода, а ней трития немного.
Понятно, что глубинный лед Гренландии или Антарктиды совсем не содержит трития – он там давно успел полностью распасться. Зная скорость образования трития в атмосфере, можно рассчитать, как долго влага находится в воздухе – с момента ее испарения с поверхности до выпадения в виде дождя или снега. Оказалось, что, например, в воздухе над океаном этот срок составляет в среднем 9 дней.
Чаще всего тритий применяют как метку при изучении механизмов реакций и их кинетики.
Синтезированный тритий сравнительно дешев и находит применение в научных исследованиях и в промышленности. Широкое применение нашли тритиевые светящиеся краски, которые наносят на шкалы приборов. Эти светосоставы с точки зрения радиации менее опасны, чем традиционные радиевые. Такие светосоставы постоянного действия используют для изготовления указателей, шкал приборов и т.п. На их производство ежегодно расходуют сотни граммов трития.
Тритий присутствует и в человеческом организме. Он поступает в него с пищей, с вдыхаемым воздухом и через кожу. Интересно, что газообразный Т2 в 500 раз менее токсичен, чем тритиевая вода Т2О. Это объясняется тем, что молекулярный тритий, попадая с воздухом в легкие, затем быстро (примерно за 3 мин) выделяется из организма, тогда как тритий в составе воды задерживается в нем на 10 суток и успевает за это время передать ему значительную дозу радиации.
Тритий имеет важное значение в реакциях термоядерного синтеза: 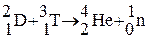 , протекающих при взрыве водородной бомбы.
, протекающих при взрыве водородной бомбы.
 2014-01-31
2014-01-31 1664
1664
