Для расстановки коэффициентов обычно используют метод электронного баланса, что требует знания степени окисления атома углерода, которая может принимать значения от -4 до +4 и зависит от относительных электроотрицательностей атомов его непосредственного окружения.
Степень окисления атомов углерода определяется числом электронных пар, смещенных к атому углерода, если его электроотрицательность выше, чем у соседнего атома, или смещенных от атома углерода, если его электроотрицательность ниже.
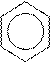
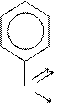
Например, степень окисления атома углерода в метильном радикале молекулы толуола равна «минус 3», т.к. электронная плотность смещается от трех атомов водорода к более электроотрицательному атому углерода по трем σ-связям. В карбоксильной группе молекулы бензойной кислоты степень окисления атома углерода равна «плюс 3», т.к. электронная плотность смещается от атома углерода к атомам кислорода по двум σ- и одной π-связи (всего по трем связям):
 | |||
 | |||
|
|
|
5 +6 KMnO4 +9 H2SO4 →5 + 3 K2SO4 +6 MnSO4 + 14H2O
 |
О
Н→C -3 ←Н С +3
↑ ОН
Н
толуол бензойная кислота
 Подбираем коэффициенты методом электронного баланса:
Подбираем коэффициенты методом электронного баланса:
С -3 – 6е- → С +3 5
Mn +7 + 5е- →Mn +2 6
Коэффициенты можно подобрать также методом электронно-ионного баланса (методом полуреакций).
Толуол С6Н5СН3 окисляется до бензойной кислоты С6Н5СООН, перманганат-ион MnO4 - восстанавливается до катиона марганца Mn+2.
С6Н5СН3 + KMnO4 + H2SO4 → С6Н5СООН+ K2SO4 +MnSO4 +H2O

 С6Н5СН3+2H2O– 6е- → С6Н5СООН+6Н+ 5
С6Н5СН3+2H2O– 6е- → С6Н5СООН+6Н+ 5
MnO4 - +8Н++ 5е- →Mn 2+ +4 H2O 6
5С6Н5СН3+ 10H2O +6MnO4 - + 48Н+ →5С6Н5СООН+ 30Н ++ 6Mn +2 + 24H2O
6 К+ 18Н+ 6SO42- 14H2O
9SO42- 6 К+ + 3SO42-
5С6Н5СН3+6КMnO4 - +9 H2SO4→5С6Н5СООН+6MnSO4 +3K2SO4 + 14H2O

В большинстве случаев окислительно-восстановительные реакции органических соединений сопровождаются отщеплением или присоединением атомов водорода и кислорода.
При окислении: введение в молекулу органического соединения атома кислорода эквивалентно потере двух электронов, а отщепление атома водорода – потере одного электрона.
При восстановлении: отщепление атома кислорода – приобретение двух электронов, присоединение атома водорода – приобретение одного электрона.
На этом принципе основан способ расстановки коэффициентов, не требующий определения степени окисления углерода. Определим число атомов водорода, потерянных толуолом, и число атомов кислорода, введенных в молекулу. Потеряно два атома водорода (-2e¯), введено два атома кислорода (-4e¯). Всего отдано 6e¯.
Рассмотрим применение различных способов расстановки коэффициентов на примере реакции между n-метилкумолом и перманганатом калия в кислой среде.
1.Окисление любых алкильных заместителей у производных бензола происходит до карбоксильных групп:
|
|
|
СН3 – СН – СН3
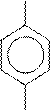
+ KMnO4 + H2SO4 →
CH3
СООН
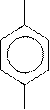
→ + K2SO4 + MnSO4 + H2O + CO2
COOH
Два атома углерода изопропильного радикала окисляются до углекислого газа.
2. Составим схему электронного баланса без определения степеней окисления атомов углерода.
Определим число атомов водорода, потерянных n-метилкумолом, и число атомов кислорода,введенных в молекулу. Потеряно восемь атомов водорода (-8e¯), введено четыре атома кислорода (-8e¯). Кроме того, четыре атома кислорода вошли в состав углекислого газа (-8e¯). Всего отдано 24e¯.
Марганец со степенью окисления +7 восстановился до +2, тогда схему электронного баланса можно записать:



 СН3 – СН – СН3 СOOH
СН3 – СН – СН3 СOOH

– 24e¯ → – 24e¯ 5
CH3 СOOH
Mn+7 +5 e¯ → Mn+2 +5 e¯ 24
4. Составим схему электронного баланса, определив степени окисления атомов углерода.
Степень окисления атомов углерода в метильных радикалах СН3 равна «плюс 3», в метиновой группе СН – «плюс 1», в карбоксильных группах – «минус 3».
 Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до карбоксильных групп, остальные атомы углерода – до углекислого газа.
Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до карбоксильных групп, остальные атомы углерода – до углекислого газа.
С-1 – 4е- →С+3
С-3 – 6е- →С+3 - 24е- 5
2 С-3 – 14е- →2С+4
Mn +7 + 5е- →Mn +2 + 5е- 24
СН3 – СН – СН3

5 + 24 KMnO4 + 36 H2SO4 →
CH3
СOOH
→ 5 + 12 K2SO4 + 24 MnSO4 + 56 H2O + 10 CO2
COOH
5. Подберем коэффициенты методом электронно-ионного баланса.
В этом случае нет необходимости изображать структурные формулы органических веществ, поэтому формулы n-метилкумола и тере фталевой кислоты запишем в молекулярном виде:
 С10Н14 +8H2O – 24е-→ С8Н6О4+2CO2+24Н+ 5
С10Н14 +8H2O – 24е-→ С8Н6О4+2CO2+24Н+ 5
MnO4 - +8Н++ 5е- →Mn 2+ +4H2O 24
5С9Н18 + 40H2O + 24MnO - 4 + 192Н+ →5С7Н6О2+10CO2+ 120Н+ +24Мn2 + + 96H2O
5С9Н18 +24MnO - 4 +72Н+→5С7Н6О2+10CO2+24Мn2 + +56H2O
24К+ 36SO42- 24SO42-
24К+ + 12SO42-
5С10Н14 +24KMnO4 + 36H2SO4 →5С7Н6О2+10CO2+12K2SO4 + 24MnSO4 + 56 H2O
 2014-01-31
2014-01-31 1441
1441








