II. Качественный анализ
Ионы окрашивают пламя в характерный цвет:
Na+ - в желтый цвет; Сu2+ - в зеленый цвет; Ва2+ - в желто-зеленый
Са2+ - в кирпично-красный; К+ - в фиолетовый;
Для обнаружения ионов используют следующие реактивы:
| Определяемый ион | Используемый реактив | Внешний эффект |
| Na+ | дигидроантимонат калия (KH2SbO4) | белый аморфный осадок |
| К+ | гексанитрокобальтат натрия (Na3 [Co(NO2)6]) гексанитрокупрат натрия (Na2Pb[Cu(NO2)6]) | желтый осадок черные или коричневые кристаллы |
| NH4+ | раствор щелочи (KOH или NaOH) реактив Несслера (K2[HgI4] + KOH) | выделяется газ NH3 бурый цвет |
| Cu2+ | избыток раствора аммиака | раствор синего цвета |
| Cu2+ | глицерин в щелочной среде | раствор синего цвета |
| Fe2+ | гексацианоферрат (III) калия (K3[Fe(CN)6]) (красная кровяная соль) | темно-синий осадок (турнбулева синь) |
| Fe3+ | гексацианоферрат (II) калия (K4[Fe(CN)6]) (желтая кровяная соль) тиоцианат аммония или калия (NH4SCN или KSCN) | темно-синий осадок (берлинская лазурь) кроваво-красное окрашивание |
| Ba2+ | H2SO4 раствор серной кислоты | белый кристаллический осадок, не раств. в кислотах |
| Ca2+ | оксалат аммония (NH4)2C2O4 | белый кристаллический осадок, не раств. в уксусной кислоте |
| Cl- | раствор нитрата серебра AgNO3 | белый творожистый осадок, не раств. в кислотах |
| Ag+ | раствор HCl | белый творожистый осадок |
| SO42- | нитрат или хлорид бария (BaNO3, BaCl) | белый кристаллический осадок |
| PO43- | Молибденовая жидкость ((NH4)2MoO4) Магнезиальная смесь (MgCl2, NH3∙H2O, NH4Cl) | желтый кристаллический осадок белый кристаллический осадок |
| Pb2+ | раствор иодида калия KI | желтый осадок |
Признаком протекания качественной реакции между иодом и крахмалом является образование синей окраски.
Индикатор метиловый оранжевый в кислой среде имеет красно-розовую окраску, в щелочной среде – желтую. Фенолфталеин в кислой среде бесцветный, в щелочной среде – малиновый.
Пример вопроса: Метиловый оранжевый окрашивается в розовый цвет в растворе…
1) Al2(SO4)3 2) Na2S 3) K2CO3 4) BaSO4
Решение: Необходимо рассмотреть подвергается ли гидролизу данная соль. Al2(SO4)3 образована слабым основанием и сильной кислотой, значит реакция среды в растворе будет слабо-кислой, т.е. метиловый оранжевый окрасится в розовый цвет. У сульфида натрия в растворе среда будет слабо-щелочной, у карбоната калия – слабо-щелочной, у сульфата бария – нейтральной, т.к. соль, образованная сильным основанием и сильной кислотой гидролизу не подвергается.
*Метод количественного анализа, основанный на измерении количества реагента, затраченного на реакцию с определяемым веществом называется титриметрическим методом анализа.*Метод химического анализа, основанный на точном измерении массы определяемого компонента пробы, выделенного либо в элементарнрм виде, либо в виде соединения определенного состава, называется гравиметрическим
Расчеты в титриметрических методах анализа основаны на законе эквивалентов. Вещества реагируют друг с другом всегда в эквивалентных количествах:
с(А)∙VA = c(B)∙VB; Количество вещества в молях выражают буквой n. n (A)= 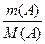 , моль.
, моль.
n (A) = c(A) VA (Объем в этом случае должен быть в л). Молярную концентрацию вещества А вычисляют по формуле: 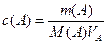 моль/л. Молярная концентрация эквивалентов вычисляется по формуле: С(f экв.А) =
моль/л. Молярная концентрация эквивалентов вычисляется по формуле: С(f экв.А) = 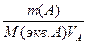 , моль∙экв/л
, моль∙экв/л
Для вычисления массы вещества в титриметрических методах анализа используют формулы: m(A) = с(f экв.А)· VA· M(экв.А)· 10-3(г) Объем выражают в мл, если в л, то на 10-3 умножать не нужно. m(B) = c(f экв.A)·VA· M(экв.B) ·10-3(г)
Пример (1). Объем 0,15 н раствора H2SO4, необходимый для осаждения ионов бария из 60 мл 0,2 н раствора BaCl2, равен… Решение:
Используем закон эквивалентов: c(f экв. H2SO4 ) V H2SO4 = c(f экв. BaCl2) V BaCl2
0,15 ∙ V H2SO4 = 60 ∙ 0,2 V H2SO4 =(60 ∙ 0,2)/ 0,15 = 80 мл. Ответ: 80 мл.
Пример (2). Для нейтрализации 100 мл 0,2 н раствора HNO3, необходим раствор, содержащий …г гидроксида натрия. 1) 0,8 2) 0,4 3) 4 4) 8 Решение:
Mэ(NaOH) = M(NaOH) = 23 + 16 + 1 = 40 г/моль;
mNaOH = VHNO3 c(HNO3) Mэ(NaOH) 10-3 = 100 ∙ 0,2 ∙ 40 ∙ 10-3 =0,8. Ответ: 0,8 г
Пример (3). Масса осадка, образующегося при сливании 50 мл 0,2 н раствора AgNO3 и 100 мл 0,1 н раствора NaCl, равна…1) 2,88 2) 1,43 3) 0,72 4) 2,16 Решение:
AgNO3 + NaCl = AgCl + NaNO3
Вещества реагируют в эквивалентных количествах, т.е. количество моль (n) продукта реакции должно быть равно количеству моль исходных веществ:
n(A) = VA c(A) моль n(AgNO3) = 50 ∙ 0,2 = 0,01 моль
n(NaCl) = 100 ∙ 0,1 = 0,01 моль, значит AgCl тоже образуется 0,01 моль.
М(AgCl) = 107,87 + 35,5 = 143,37 г/моль; M(AgCl) = 143,37 ∙ 0,01 = 1,43 г
Ответ: m(AgCl) =1,43 г.
 2013-12-31
2013-12-31 1005
1005








