НАНЕСЕНИЕ ИНФЕКЦИИ НА ЦВЕТКИ РАСТЕНИЙ
ЗАРАЖЕНИЕ СТВОЛОВ И ВЕТВЕЙ ДЕРЕВЬЕВ
Этот метод инокуляции применяют при оценке устойчивости цитрусовых культур к мальсекко, плодовых древесных пород к ци-тоспорозу, черному и бактериальному раку, а также некоторым другим болезням. Обычно при таком способе заражения инфекцию в виде мицелия или суспензии наносят в места механических поранений коры. На ветвях срезают или надрезают кусочки коры, наносят под нее инфекцию, накладывают кору на место среза и обвязывают место инокуляции пергаментом или полиэтиленовой пленкой.
Например, яблоню инокулируют возбудителем черного рака таким образом. С различных сортов яблони собирают кусочки коры, пораженные грибом Sphaeropsis malorum. Небольшие кусочки коры с пикнидами переносят на картофельно-глюкозную или сусло-агаровую питательную среду, на которой гриб развивается до конидиальной стадии. Обычно это занимает около 20 дней. В мае—начале июня, когда среднесуточная температура воздуха достигает примерно 18 °С, на выбранных для заражения ветвях делают Т-образный надрез коры. Под кору вносят кусочки мицелия со спорами. Рану обматывают смоченной в воде ватой и пергаментной бумагой и перевязывают для удержания. Результаты заражения анализируют через 3...4 мес.
Часто для инфекции возбудителями усыхания плодовых культур инфекционную суспензию вносят под кору с помощью шприца. При этом удобнее всего использовать шприц непрерывного действия, вводя с его помощью по 0,5... 1 мл суспензии в одно место инокуляции. Инфекцию грибов рода Cytospora наносят помещением капли споровой суспензии в пазуху листа годичного побега с последующим нанесением в это место двух-трех уколов энтомологической иглой.
Этот метод применяют при оценке устойчивости пшеницы и ячменя к пыльной головне, плодовых культур к монилиальному ожогу, ржи к спорынье и некоторых культур к бактериозам. Заражение через цветки проводят путем заспорения или обработкой водной суспензией патогена, прибегая к простейшим приспособлениям в виде кисточки, пинцета, пульверизатора (рис. 41). Наряду с ними применяют и более сложную аппаратуру специальных конструкций с использованием вакуума (рис. 42). При нанесении инфекции возбудителей пыльной головни пшеницы и пыльной
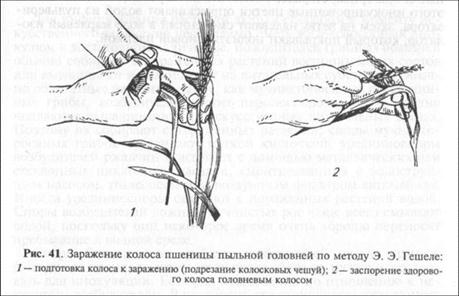
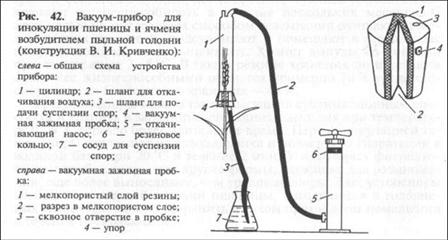
головни ячменя используют методы заспорения как отдельного цветка, так и всех цветков колоса сразу. В первом случае удается добиться более высокого процента удачных заражений, но производительность при этом довольно низкая.
При инокулировании возбудителем монилиального ожога увлажненным концом иглы наносят на цветки сухие жизнеспособные споры гриба, стараясь поместить их на рыльце пестика. После этого инокулированные цветки опрыскивают водой из пульверизатора, затем на ветвь надевают смоченный в воде марлевый изолятор, который покрывают полиэтиленовой пленкой.
Для инфицирования растений любым способом к моменту искусственного заражения необходимо иметь жизнеспособный ино-кулюм в достаточном количестве. Возбудителей грибных болезней обычно собирают с пораженных растений восприимчивых сортов или выращивают и размножают на питательных субстратах. Обычно облигатные паразиты, такие, как мучнисторосяные и ржавчинные грибы, возбудители многих пероноспорозов очень трудно поддаются выращиванию на искусственных питательных средах. Поэтому их собирают с пораженных растений; споры мучнисто-росяных грибов стряхивают мягкой кисточкой, урединиоспоры возбудителей ржавчин всасывают с помощью металлических или стеклянных циклонных насадок, смонтированных с водоструйным насосом, пылесосом или воздушным фильтром автомобиля. Иногда урединиоспоры смывают с пораженных растений водой. Споры возбудителей ложных мучнистых рос чаще всего смывают водой, поскольку они некоторое время очень хорошо переносят пребывание в водной среде.
Споры большинства грибных возбудителей нельзя хранить длительное время, поэтому сразу после сбора их нужно использовать для инокуляции. Есть ряд исключений по отношению к некоторым возбудителям. В частности, урединиоспоры ржавчинных грибов, собранные сухими, после соответствующей обработки сохраняют жизнеспособность в течение нескольких месяцев. С этой целью их после сбора способом всасывания очищают от механических примесей, подсушивают и помещают в стеклянные ампулы, которые затем запаивают. Хранят ампулы со спорами при температуре 3...5 °С. В таком режиме хранения по истечении 2...2,5 мес жизнеспособными остаются примерно 70 % урединиоспор, а после 6-месячного хранения — 40 %.
Урединиоспоры можно также высушить сублимационным способом и хранить в запаянных стеклянных ампулах при температуре 0...5 °С гораздо более длительное время. Перед инокуляцией такие споры извлекают из холодильника и подвергают гидратации в водяной бане при 20 °С в течение 2 мин. У некоторых фитопато-генных грибов споры или другие формы, служащие для размножения, еще более выносливые, чем урединиоспоры. Так, устооспоры возбудителя твердой головни пшеницы, находящиеся в головневых мешочках, можно сохранить в сухом прохладном помещении в течение нескольких лет.
Ряд грибных возбудителей образуют в цикле развития скле-роции. Эта покоящаяся форма мицелия крайне устойчива к неблагоприятным внешним условиям без потери жизнеспособности. Поэтому склероции этих грибов собирают и могут хранить несколько лет. При надобности создают условия для прорастания склероциев и получения тех форм, которые могут вызвать заражение растений. В виде склероциев хранят возбудителей рака клевера, склеротиниоза и тифулеза зерновых культур, белой гнили овощных культур, подсолнечника и ряда других растений.
Возбудителей мучнистых рос злаковых культивируют на молодых растениях ячменя. Гриб можно поддерживать в живом состоянии даже на проростках восприимчивых сортов, растущих в пробирках размером 25 х 300 мм. В таком состоянии возбудитель сохраняется в течение 1... 1,5 мес в холодильных камерах (при 12 °С), оборудованных освещением. Для более длительного хранения гриб периодически с интервалом 1... 1,5 мес переносят на новые проростки.
Патогенов, вызывающих ложные мучнистые росы, размножают на вегетирующих растениях восприимчивых сортов с таким расчетом, чтобы непосредственно перед инокуляцией у них было хорошо развито конидиальное спороношение, которое смывают водой.
Очень многие грибные патогены способны расти и размножаться на питательных субстратах в лабораторных условиях. Выбор конкретной питательной среды для размножения таких грибов зависит от их видовой принадлежности, способности хорошо и быстро развиваться и давать большое количество инфекционных единиц (чаще спор). Перед использованием их в качестве инокулюма проверяют агрессивность возбудителя, заражая им восприимчивые сорта.
Фитопатогенные бактерии можно успешно культивировать в лабораторных условиях на питательных средах. Бактерии характеризуются небольшой избирательностью по отношению к виду питательного субстрата. Для искусственного заражения растений обычно пользуются водной суспензией бактериальных клеток нужной концентрации.
Жизнеспособность возбудителей вирусных болезней поддерживают на живых растениях, которые легко ими поражаются и в тканях которых вирусные частицы накапливаются в высоких концентрациях. Такие растения называют растениями-накопителями. Инфекцию с них переносят на испытуемые растения с помощью ранее перечисленных методов, выбор которых зависит от способа передачи конкретного фитопатогенного вируса.
 2013-12-31
2013-12-31 724
724








