Таблица калорийности масел, жиров, яиц и соусов
Таблица калорийности сладостей
Таблица калорийности мяса, мясных субпродуктов и птицы
Таблица калорийности рыбы и морепродуктов
Таблица калорийности молока и молочных продуктов
Таблица калорийности орехов, семечек и сушеных плодов
Таблица калорийности хлеба, хлебобулочных и мучных изделий
Таблица калорийности круп, зернобобовых бобовых
Таблица калорийности овощей, зелени, грибов
ЩУК
Задание 2. Учет затрат и услуг энергетического хозяйства
Журнал хозяйственных операций
| № п/п | Содержание операций | Сумма, руб. | Дебет | Кредит |
| 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. | Начислена оплата труда работникам ремонтной мастерской, занятым на: - капитальном ремонте автомобиля «ГАЗ» - текущем ремонте автомобиля «ЗИЛ» - административно-управленческому персоналу Произведены начисления задолженности по страховым взносам (налог по травматизму -1,5%) с оплаты труда работников, занятых на: - капитальном ремонте автомобиля «ГАЗ» - текущем ремонте автомобиля «ЗИЛ» - административно-управленческому персоналу Произведены отчисления в резерв на оплату отпусков (6%) по: - капитальному ремонту автомобиля «ГАЗ» - текущему ремонту автомобиля «ЗИЛ» - - административно-управленческому персоналу Списаны запасные части, израсходованные на: - капитальный ремонт автомобиля «ГАЗ» - текущий ремонт автомобиля «ЗИЛ» Списаны смазочные материалы на: - капитальный ремонт автомобиля «ГАЗ» - текущий ремонт автомобиля «ЗИЛ» Списана ветошь на протирку деталей и отнесена на: - капитальный ремонт автомобиля «ГАЗ» - текущий ремонт автомобиля «ЗИЛ» Списано топливо на обкатку машин после ремонта: - автомобиля «ГАЗ» - автомобиля «ЗИЛ» Списана электроэнергия, использованная в ремонтной мастерской Списана стоимость плакатов по охране труда и технике безопасности Начислена амортизация по основным средствам ремонтной мастерской Распределены цеховые расходы ремонтной мастерской на: - капитальный ремонт автомобиля «ГАЗ» - текущий ремонт автомобиля «ЗИЛ» Списаны затраты ремонтной мастерской по: - капитальному ремонту автомобиля «ГАЗ» - текущему ремонту автомобиля «ЗИЛ» | ? 97.5 ? 36 ? 57 ? 395,85 ? 146,16 ? 231,42 ? 6580,53 ? 2433,89 ? 42603,88 ? 19516,05 | 23-1.1 23-2 23-1.3 23.1.1. 23.1.2 23.1.3 23.1.1 23.1.2 23.1.3 23.1.1 23.1.2 23.1.1 23.1.2 23.1.1 23.1.2 23.1.1 23.1.2 23.1.3 23.1.3 21.1.3 23.1.1 23.1.2 23.1.1 23.1.2 | 10.5 10.5 10.5 10.5 10.6 10.6 10.3 10.3 23.5 10.9 23.1.3 23.1.3 23.1.1 23.1.2 |
Затраты административно-управленческого персонала распределяются пропорционально заработной плате основных производственных рабочих
На основании содержания хозяйственных операций требуется:
- Осуществить корреспонденцию счетов по каждой операции.
- Рассчитать себестоимость 1 кВтч и определить калькуляционные разницы.
- Произвести списание сумм разниц между плановой и фактической себестоимостью электроэнергии.
Журнал хозяйственных операций
| № п/п | Содержание операций | Сумма, руб. | Дебет | Кредит |
| 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. | Начислена оплата труда работникам, занятым на выработке электроэнергии собственной электростанцией Произведены начисления задолженности по страховым взносам: -пенс.фонд 22% -соц.страх. 2.9% -мед.страх. 5.1% +налог от нес.случаев 1.5% Отчислено в резерв на оплату отпусков (7%) Списаны нефтепродукты, израсходованные на работу электростанции Начислена амортизация по основным средствам Списаны затраты по текущему ремонту Получен и списан на производство инвентарь, сроком полезного использования до 12 месяцев Передана со склада спецодежда Списаны услуги вспомогательных производств Оплачено за получение электроэнергии со стороны ИТОГО ЗАТРАТ: (фактически!) Использовано электроэнергии в течение года по плановой себестоимости 0,60 руб. за 1 кВт.ч. - Цех 1 – 110000 кВт.ч. - Цех 2 – 260000 кВт.ч. - Цех 3 – 105000 кВт.ч. - другие вспомогательные производства – 55000 кВт.ч. - общепроизводственные расходы –75000 кВт.ч. - общехозяйственные расходы – 45000 кВт.ч. - жилищно-коммунальное хозяйство – 250000 кВт.ч. - строительство – 12000 кВт.ч. ВСЕГО: 912000 кВт.ч. Списана сумма разницы между плановой и фактической себестоимостью электроэнергии на: - Цех 1 Цех 2 - Цех 3 - другие вспомогательные производства - общепроизводственные расходы - общехозяйственные расходы - жилищно-коммунальное хозяйство - строительство ИТОГО: | ? 8800 ? 1160 ? 2040 ? 600 ? ? 66000 ? 156000 ? 63000 ? 33000 ? 45000 ? 27000 ? 150000 ? 7200 ? 547200 ? ? ? ? ? ? ? ? ? | 23.5 23.5 23.5 23.5 23.5 23.5 23.5 23.5 23.5 23.5 23.5 23.5 23.5 20.1 20.2 20.3 20.4 20.5 | 69.2 69.1 69.3 69.4 10.3 23.1 10.9 10.9 23.5 23.5 23.5 23.5 23.5 23.5 23.5 |
Расчет себестоимости 1 кВтч и определение калькуляционных разниц.
| Объекты учета | Объем услуг, кВт.ч. | Фактические затраты, руб. | Себестои момсть 1 кВт.ч., руб. | Плановые затраты, руб. | Сумма калькуля ционной разницы |
| Цех 1 Цех 2 Цех 3 Другие вспомогательные производства Общепроизводственные расходы Общехозяйственные расходы Жилищно-коммунальное хозяйство Строительство ИТОГО: | 7440+2502 565440+2502=567942 | 0.62 0.62 0.62 0.62 0.62 0.62 0.62 0.62 0.62 |
Факт. с\с 1 кВт.ч. = сумма фактических затрат нужно разделить на количество электроэнергии. = 0.62
2502 рубля – математическая погрешность
Калькуляционная разница на единицу (одного кВт.ч.) это фактическая себестоимость минус плановая себестоимость
0.62-0.60=0.02
Калькуляционная разница на весь объем продукции это из фактических затрат отнимаем плановые затраты
567942-547200=20762
Реакция катализируется ферментом фосфоенолпируваткарбоксилазой (ФЕП-карбоксилазой) с образованием ЩУК. Поскольку в этом случае первый продукт карбоксилирования - ЩУК содержит 4 атома углерода, его называют «С-4» путь, в отличии от цикла Кальвина, где образуется ФГК, содержащая 3 атома углерода («С-3» путь).ЩУК преобразуется в яблочную кислоту. В последующем происходит реакция транскарбоксилирования, при которой СО2снова отщепляется от органических кислот и вступает в цикл Кальвина - присоединяется к РДФ. Таким образом, сущность «С-4»пути заключается в том что реакция карбоксилирования происходит 2 раза. Это позволяет растению создавать запасы углерода в клетках. Как и во всяком биохимическом цикле, акцепторы (ФЕП и РДФ) регенерируют, что и создает возможность его непрерывного функционирования. Исследования показали, что в растениях, в которых процесс фотосинтеза протекает по «С-4» пути, имеются 2 типа хлоропластов: 1) крупные пластиды, часто лишенные гранул, в клетках обкладки, окружающие сосудистые пучки; 2) мелкие гранальные пластиды в клетках мезофила листа.
В клетках мезофила с мелкими хлоропластами осуществляется карбоксилирование фосфоенолпировиноградной кислоты с образованием 4-углеродногосоединения - ЩУК (и в некоторых случаях аспарагиновой кислоты.). Затем ЩУК передвигается в клетки обкладки, где происходит реакция транскарбоксилирования, в результате которой СО2отщепляется и вступает в цикл Кальвина. При этом фосфоенолпировиногрвдная кислота (ФЕП) регенерирует. Поскольку при таком механизме фотосинтеза принимает участие 2 типа клеток и 2 типа хлоропластов, этот путь называют кооперативным. Фиксация СО2 по «С-4» пути имеет ряд преимуществ. Показано, что некоторые представители растений, ведущие ассимиляцию по «С-4» пути, осуществляют первые этапы этого процесса (образование органических кислот) в ночной период суток. В последующий светлый период углекислота освобождается и реассимилируется в цикле Кальвина. Такая последовательность позволяет осуществлять фотосинтез днем при закрытых устьицах, что имеет большое значение, т.к. предохраняет растение от излишней потери воды. Возможно, именно с этим связано большая засухоустойчивость растений с таким типом фотосинтеза.
У растений, осуществляющих фотосинтез по «С-4» пути, отсутствует процесс фотодыхания. Это последнее обстоятельство уменьшает непроизводительную трату органического вещества и увеличивает продуктивность растений. Открытие «С-4» пути позволило расшифровать особенности фотосинтеза у суккулентов. Оказалось, что суккуленты в ночное время фиксируют углерод в органических кислотах, по преимуществу в яблочной. По-видимому это происходит под действием фермента пируваткарбоксилазы. Далее эта фиксированная углекислота с помощью транскарбоксилирования переносится на неидентифицированный акцептор и используется для образования триоз. Осуществление фотосинтеза по такому пути позволяет суккулентам в течении дня держать устьица закрытыми и таким образом сокращать транспирацию.
В литературе имеются указания о наличии других путей связывания СО2. Однако они еще недостаточно охарактеризованы. Важно также подчеркнуть, что на всех этапах фотосинтетического цикла промежуточные продукты могут претерпевать различные превращения в зависимости от условий среды. Именно это является основой для образования разнообразных продуктов фотосинтеза.
ВЛИЯНИЕ ВОДОЙ НА ИНТЕНСИВНОСТИ ФОТОСИНТЕЗА
Вода является непосредственным участником процесса фотосинтеза. Однако количество воды, необходимое для образования углеводов, ничтожно мало по сравнению с общим содержанием воды, необходимым для поддержания клетки в тургорном состоянии. Вместе с тем при полной насыщенности водой клеток листа фотосинтез снижается. Частично это может быть связано с тем, что при полном насыщении клеток мезофилла замыкающие устьичные клетки оказываются несколько сдавленными, устьичные щели не могут открыться (гидропассивные движения). Однако дело не только в этом. Небольшое обезвоживание листьев сказывается благоприятно на процессе фотосинтеза и вне зависимости от степени открытия устьиц. Так, погружение листьев в раствор маннита в концентрации 0,2—0,4 М вызывает водный дефицит, равный 15—20%, и некоторое возрастание интенсивности фотосинтеза. Таким образом, небольшой водный дефицит (5—15%) в клетках листьев оказывает благоприятное влияние на интенсивность фотосинтеза (В.А. Бриллиант). По-видимому, в процессе эволюции выработаны приспособления работы ферментов к небольшому водному дефициту. Действительно, небольшой водный дефицит активизирует ряд ферментов (Н.М. Сисакян).
Увеличение водного дефицита свыше 15—20% приводит к уже заметному снижению интенсивности фотосинтеза. Это связано в первую очередь с закрытием устьиц (гидроактивные движения), что резко уменьшает диффузию С02 в лист. Кроме того, это вызывает сокращение транспирации, и, как следствие, возрастает температура листьев. Между тем повышение температуры выше 30°С вызывает снижение фотосинтеза. Наконец, обезвоживание оказывает влияние на конформацию, а следовательно, и активность ферментов, принимающих участие в темновой фазе фотосинтеза, повреждает структуру тилакоидов. При обезвоживании также замедляется процесс фотофосфорилирования (И.А. Тарчевский). Длительное обезвоживание растений может привести к тому, что интенсивность фотосинтеза не восстанавливается после улучшения снабжения водой.
ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА ИНТЕНСИВНОСТЬ ФОТОСИНТЕЗА
Влияние температуры на фотосинтез находится в зависимости от интенсивности освещения. При низкой освещенности фотосинтез от температуры не зависит (Q10=1). Следовательно, при низком уровне освещенности фотосинтез идет с одинаковой скоростью при 15° и 25°С. Это связано с тем, что при низкой освещенности интенсивность фотосинтеза лимитируется скоростью световых реакций. Напротив, при высокой освещенности скорость фотосинтеза определяется протеканием темновых реакций. В этом случае влияние температуры проявляется очень отчетливо и температурный коэффициент Q10 может быть около двух. Так, для подсолнечника повышение температуры в интервале от 9 до 19°С увеличивает интенсивность фотосинтеза в 2,5 раза.
Температурные пределы, в которых возможно осуществление процессов фотосинтеза, различны для разных растений. Понижение температуры влияет на фотосинтез прямо, уменьшая активность ферментов, участвующих в темновых реакциях, и косвенно, благодаря повреждению органелл. Минимальная температура для фотосинтеза растений средней полосы около 0°С, для тропических растений 5—10°С. Имеются данные, что ранневесенние и высокогорные растения могут осуществлять фотосинтез и при температуре ниже 0°С. Лишайники могут ассимилировать С02при температуре —25°С. Оптимальная температура фотосинтеза для большинства растений средней полосы составляет примерно 20—25°С. При этом для растений, ведущих фотосинтез по С4-пути, оптимальная температура более высокая (35—45°С и выше), для цианобактерий оптимум температуры фотосинтеза значительно выше. При температуре выше оптимальной интенсивность фотосинтеза резко падает. Это связано с тем, что зависимость процесса фотосинтеза от температуры представляет собой равнодействующую противоположных процессов. Так, повышение температуры увеличивает скорость темновых реакций фотосинтеза. Одновременно при температуре 25—30°С происходит процесс инактивации хлоропластов. Повышение температуры может вызвать также закрытие устьичных щелей. Наконец, как уже говорилось, повышение температуры увеличивает интенсивность дыхания, и в этой связи видимый фотосинтез (разность между фотосинтезом и дыханием) уменьшается. Понижение температуры также снижает фотосинтез, поскольку тормозится активность ферментов, уменьшается скорость диффузионных процессов, а также отток ассимилятов.
ВЛИЯНИЕ КИСЛОРОДА НА ИНТЕНСИВНОСТИ ФОТОСИНТЕЗА
Зависимость фотосинтеза от концентрации кислорода в среде довольно сложна. Как правило, процесс фотосинтеза высших растений осуществляется в аэробных условиях при концентрации кислорода около 21 %. Исследования показали, что как увеличение концентрации кислорода, так и отсутствие его неблагоприятны для фотосинтеза.Действие кислорода зависит от его концентрации, вида и физиологического состояния растения, других условий внешней среды. Обычная концентрация кислорода в атмосфере (21 %) не является оптимальной, а значительно превышает последнюю. Поэтому снижение парциального давления кислорода до 3 % практически не сказывается отрицательно на фотосинтезе, а в ряде случаев может даже активировать его. У растений различных видов снижение концентрации кислорода вызывает неодинаковый эффект. Так, по данным А.А Ничипоровича (1973), уменьшение концентрации кислорода от 21 до 3 % сказывалось благоприятно на растениях с активным фотодыханием (бобы). Для кукурузы, у которой фотодыхание почти отсутствует, не отмечено изменений в интенсивности фотосинтеза при переходе от 21 до 3% 02.Неоднозначное и часто противоположное влияние разных концентраций кислорода на фотосинтез обусловлено тем, что конечный эффект зависит от направленности действия нескольких механизмов. Известно, что присутствие кислорода необходимо для
нормального функционирования электрон-транспортной цепи. Ряд
компонентов ЭТЦ (ферредоксин, хиноны) могут взаимодействовать с 02, регулируя таким образом редокс-состояние цепи. При активном потоке электронов влияние кислорода положительно, так как «разгружает» цепь. Этот механизм имеет положительное значение также в том случае, когда нарушена регенерация НАДФ+. Возможность сброса электронов на 02 обеспечивает функционирование ЭТЦ и запасание энергии в реакциях псевдоциклического фотофосфорилирования. Вместе с тем сброс электронов ЭТЦ на кислород приводит к образованию активных форм кислорода (АФК), которые могут вызывать нарушения фотосинтезирующих структур и ингибировать фотосинтез. При слабом электронном
потоке кислород, конкурируя за электроны, также снижает эффективность работы ЭТЦ.Другим достаточно хорошо изученным механизмом действия кислорода на фотосинтез является его влияние на ключевой фермент фотосинтеза — РуБФ-карбоксилазу. Хорошо установлено ингибирующее действие высоких концентраций 02 на карбоксилазную функцию фермента и активирующее действие на его оксигеназную функцию (на скорость фотодыхания). В зависимости от концентрации С02 в среде ингибирующее действие высоких концентраций кислорода на фотосинтез может проявиться в большей или меньшей степени. Этот механизм лежит в основе явления, известного как«эффект Варбурга».В 1920 г. Варбург впервые обнаружил ингибирующее действие высоких концентраций кислорода на фотосинтез водорослиChlorella.Эффект Варбурга отмечен для многих видов высших растений (O.Bjorkman, 1966), а также при исследовании фиксации С02 изолированными хлоропластами (R.Everson, M.Gibbs, 1967). Кислородное ингибирование фотосинтеза, по мнению многих исследователей, обусловлено двумя составляющими — прямым ингибированием РуБФ-карбоксилазы за счет высоких концентраций 02 и активацией процесса фотодыхания. При повышении концентрации С02 в атмосфере степень кислородного ингибирования фотосинтеза существенно снижается.Эффект Варбурга проявляется не у всех растений, у ряда растений аридных пустынь обнаружен «антиэффект Варбурга» — подавление фотосинтеза низкими концентрациями кислорода (1%О2) (А. Т. Мокроносов, 1981, 1983). Исследования показали, что положительное или отрицательное влияние 02 на фотосинтез зависит от соотношения в листе фототрофных и гетеротрофных тканей. У растений, где фототрофные ткани составляют большую часть объема листа, при низком содержании кислорода проявляется усиление фотосинтеза. У растений, содержащих большую долю гетеротрофных тканей, в этих условиях проявляется «антиэффект Варбурга» — подавление фотосинтеза в бескислородной среде. Это противоположное действие низких концентраций кислорода обусловлено сложным взаимодействием фотосинтеза, фотодыхания и темнового дыхания в клетках листа разного типа (фототрофных, гетеротрофных).
ВЗАИМОСВЯЗЬ ДЫХАНИЯ И БРОЖЕНИЯ.
Брожение — это внутренний окислительно-восстановительный процесс, при котором акцептором электронов служит органическая молекула и суммарная степень окисления образующихся продуктов, отличается от степени окисления сбраживаемого вещества. С.П. Костычев выдвинул положение о генетической связи процессов брожения и дыхания. При этом он опирался на следующие факты:
1. У высших растений был найден весь набор ферментов, который катализирует отдельные этапы процесса брожения.
2. При временном попадании в условия анаэробиоза высшие растения определенное время существуют за счет энергии, выделяющейся в процессе брожения. Правда, поскольку процесс брожения энергетически значительно менее эффективен, в анаэробных условиях рост растений приостанавливается. Кроме того, продукты брожения, в частности спирт, ядовиты, и их накопление приводит к гибели растения.
3. При добавлении к клеткам факультативных анаэробов (дрожжи) полусброженных Сахаров интенсивность дыхания у них резко возрастает, следовательно, полусброженные продукты являются лучшим субстратом дыхания по сравнению с неизмененными сахарами.
В настоящее время общепризнано, что первые этапы (гликолиз) протекают одинаково при процессах, как дыхания, так и брожения. Поворотным моментом является образование пировиноградной кислоты. В аэробных условиях пировиноградная кислота распадается до С02 и воды в результате декарбоксилирования и цикла Кребса (дыхание), тогда как в анаэробных она преобразуется в различные органические соединения (брожение). Организм обладает способностью при изменении условий переключать процессы, прекращая брожение и усиливая дыхание и наоборот. Впервые в опытах Пастера было показано, что в присутствии кислорода процесс брожения у дрожжей тормозится и заменяется процессом дыхания. Одновременно резко сокращается распад глюкозы. Это явление оказалось характерным для всех факультативных анаэробных организмов, включая высшие растения, и получило название эффекта Пастера. Сокращение расхода глюкозы в присутствии кислорода целесообразно, поскольку при дыхательном распаде выход энергии значительно выше, а следовательно, глюкоза используется более экономно. Однако осуществление разбираемого эффекта требует специальных механизмов, которые будут рассмотрены далее. В зависимости от получаемого продукта различают разные типы брожения. При спиртовом брожении пировиноградная кислота, образовавшаяся в процессе гликолиза, декарбоксилируется с образованием уксусного альдегида при участии фермента пируватдекарбоксилазы, а затем восстанавливается до этилового спирта ферментом алкогольдегидрогеназой:
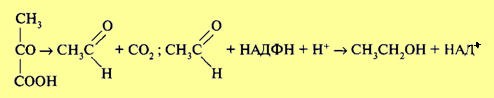
Обе эти реакции не сопровождаются образованием АТФ. В связи с этим выход АТФ при спиртовом брожении такой же, как при гликолизе (первой фазы брожения и дыхания), и составляет две молекулы при распаде 1 моль глюкозы. Восстановленные никотинамидные коферменты НАДН + Н+, образовавшиеся в процессе гликолиза, не поступают в дыхательную цепь (у анаэробных оргАнизмов ее и нет), а используются для восстановления уксусного альдегида до спирта. Следовательно, энергетический выход процессов брожения крайне низок. Разные микроорганизмы осуществляют и разные типы брожения. Так, молочнокислые бактерии накапливают молочную кислоту. При этом пировиноградная кислота восстанавливается до молочной кислоты:
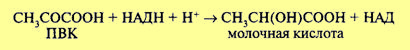
Для некоторых облигатных анаэробных микроорганизмов, например азотфиксирующей бактерии Clostridium pasteurianum, характерно образование в процессе брожения масляной кислоты, С02и N2. Процесс брожения служит источником энергии для облигатных (обязательных) или факультативных анаэробных организмов. Обе эти реакции не сопровождаются образованием АТФ. В связи с этим выход АТФ при спиртовом брожении такой же, как при гликолизе (первой фазы брожения и дыхания), и составляет две молекулы при распаде 1 моль глюкозы. Восстановленные никотинамидные коферменты НАДН + Н+, образовавшиеся в процессе гликолиза, не поступают в дыхательную цепь (у анаэробных организмов ее и нет), а используются для восстановления уксусного альдегида до спирта. Следовательно, энергетический выход процессов брожения крайне низок. Разные микроорганизмы осуществляют и разные типы брожения. Так, молочнокислые бактерии накапливают молочную кислоту. При этом пировиноградная кислота восстанавливается до молочной кислоты: Для некоторых облигатных анаэробных микроорганизмов, например азотфиксирующей бактерии Clostridium pasteurianum, характерно образование в процессе брожения масляной кислоты, С02 и N2. Процесс брожения служит источником энергии для облигатных (обязательных) или факультативных анаэробных организмов.
АНАЭРОБНЫЕ ПРЕВРАЩЕНИЯ ПРОДУКТОВ ГЛИКОЛИЗА
Гликолитический путь представляет собой 10 последовательных реакций, каждая из которых катализируется отдельным ферментом.
Процесс гликолиза условно можно разделить на два этапа. Первый этап, протекающий с расходом энергии 2-х молекул АТФ, заключается в расщеплении молекулы глюкозы на 2 молекулы глицеральдегид-3-фосфата. На втором этапе происходит НАД-зависимое окисление глицеральдегид-3-фосфата, сопровождающееся синтезом АТФ. Сам по себе гликолиз является полностью анаэробным процессом, то есть не требует для протекания реакций присутствия кислорода.
Первой реакцией гликолиза является фосфорилирование молекулы глюкозы, происходящее при участии тканеспецифичного фермента гексокиназы с затратой энергии 1 молекулы АТФ; образуется активная форма глюкозы—глюкозо-6-фосфат(Г-6-Ф):

Для протекания реакции необходимо наличие в среде ионовMg2+, с которым комплексно связывается молекула АТФ. Эта реакция необратима и является первой ключевой реакцией гликолиза.
Фосфорилирование глюкозы преследует две цели: во-первых, из-за того что плазматическая мембрана, проницаемая для нейтральной молекулы глюкозы, не пропускает отрицательно заряженные молекулы Г-6-Ф, фосфорилированная глюкоза оказывается запертой внутри клетки. Во-вторых, при фосфорилировании глюкоза переводится в активную форму, способную участвовать в биохимических реакциях и включаться в метаболические циклы.
Печёночный изофермент гексокиназы—глюкокиназа— имеет важное значение в регуляции уровня глюкозы в крови.
В следующей реакции (2) ферментом фосфоглюкоизомеразой Г-6-Ф превращается во фруктозо-6-фосфат(Ф-6-Ф):
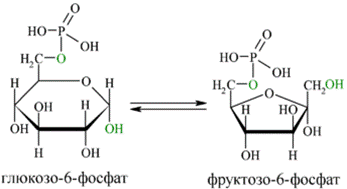
Энергия для этой реакции не требуется, и реакция является полностью обратимой. На данном этапе в процесс гликолиза может также включаться путём фосфорилирования и фруктоза.
Далее почти сразу друг за другом следуют две реакции: необратимое фосфорилирование фруктозо-6-фосфата (3) и обратимое альдольное расщепление образовавшегося фруктозо-1,6-бифосфата (Ф-1,6-бФ) на две триозы (4).
Фосфорилирование Ф-6-Ф осуществляется фосфофруктокиназой с затратой энергии ещё одной молекулы АТФ; это вторая ключевая реакция гликолиза, её регуляция определяет интенсивность гликолиза в целом.
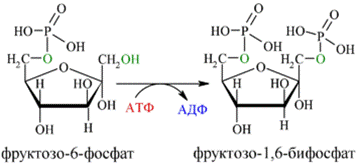
Альдольное расщепление Ф-1,6-бФ происходит под действием альдолазы фруктозо-1,6-бифосфата:
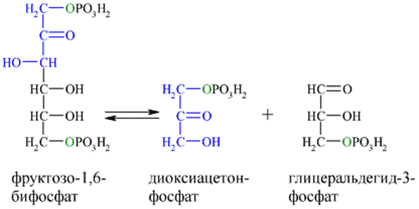
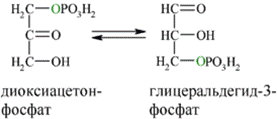
В результате четвёртой реакции образуются дигидроксиацетонфосфат и глицеральдегид-3-фосфат, причём первый почти сразу под действием фосфотриозоизомеразы переходит во второй (5), который и участвует в дальнейших превращениях:
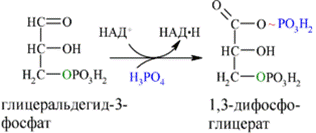
Каждая молекула глицеральдегидфосфата окисляется НАД+ в присутствии дегидрогеназы глицеральдегидфосфата до 1,3-дифосфоглицерата(6):
Далее с 1,3-дифосфоглицерата, содержащего макроэргическую связь в 1 положении, ферментом фосфоглицераткиназой на молекулу АДФ переносится остаток фосфорной кислоты (реакция7)— образуется молекулаАТФ:
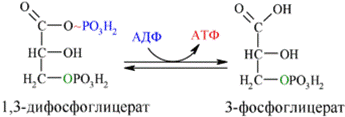
Это первая реакция субстратного фосфорилирования. С этого момента процесс расщепления глюкозы перестаёт быть убыточным в энергетическом плане, так как энергетические затраты первого этапа оказываются компенсированными: синтезируются 2 молекулы АТФ (по одной на каждый 1,3-дифосфоглицерат) вместо двух потраченных в реакциях 1 и 3. Для протекания данной реакции требуется присутствие в цитозоле АДФ, то есть при избытке в клетке АТФ (и недостатке АДФ) её скорость снижается. Поскольку АТФ, не подвергающийся метаболизму, в клетке не депонируется а просто разрушается, то эта реакция является важным регулятором гликолиза.
Затем последовательно:фосфоглицеролмутаза образует 2-фосфоглицерат(8):
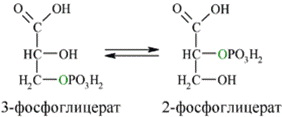
Енолаза образует фосфоенолпируват (9):
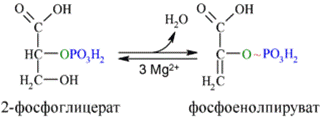
И наконец происходит вторая реакция субстратного фосфорилирования АДФ с образованием енольной формы пирувата и АТФ (10):

Реакция протекает под действием пируваткиназы. Это последняя ключевая реакция гликолиза. Изомеризация енольной формы пирувата в пируват происходит неферментативно.
С момента образования Ф-1,6-бФ с выделением энергии протекают только реакции7 и 10, в которых и происходит к субстратное фосфорилирование АДФ.
ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ДЫХАТЕЛЬНОГО ОБМЕНА
Наряду с разложением глюкозы в процессе гликолиза существует другой, не менее распространенный путь — пентозофосфатный, или апотомический. В этом случае глюкоза также подвергается первоначальному фосфорилированию с образованием глюкозо-6-фосфата, затем пути расходятся. Монофосфорный эфир глюкозы подвергается окислению при участии фермента глюкозо-6-фосфатде-гидрогеназы. Коферментом является НАДФ, при этом образуется фосфоглюконовая кислота. Процесс происходит следующим образо
На следующем этапе происходит процесс окислительного декарбоксилирования фосфоглюконовой кислоты. В результате этой реакции отщепляется одна молекула углекислого газа и образуется пятиуглеродный сахар рибулезо-5-фосфат. Отсюда и название — пентозофосфатный цикл или апотомический путь (апотомия — усекновение). Реакция катализируется ферментом фосфоглюконатдегидрогеназой с коферментом НАДФ:
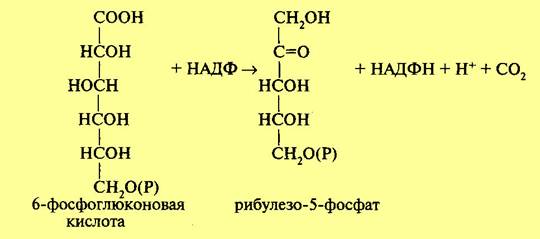
Обе рассмотренные реакции необратимы. Последующие реакции представляют цикл. Для прохождения полного цикла реакций необходимы три молекулы гексозомонофосфата, которые превращаются в три молекулы рибулезо-5-фос-фата по уравнению:

Три образовавшиеся молекулы пентозы (рибулезо-5-фосфат) претерпевают превращения. Первая молекула рибулезо-5-фосфата под влиянием фермента эпимеразы превращается в ксилулозо-5-фосфат. Вторая молекула рибулезо-5-фосфата превращается в рибозо-5-фосфат под влиянием фермента фосфопентоизомеразы. Ксилулозо-5-фосфат реагирует с рибозо-5-фосфатом, в результате получается семиуглеродный сахар — седогептулозо-7-фосфат и фосфоглицериновый альдегид. Эта последняя реакция идет под влиянием фермента транскетолазы:
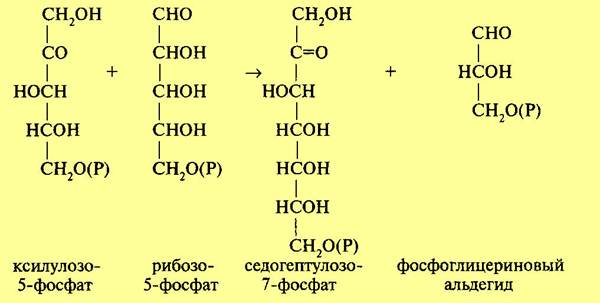
Семиуглеродный сахар реагирует с ФГА, при этом образуется фруктозо-6-фос-фат и эритрозофосфат. Фруктозо-6-фосфат изомеризуется до глюкозо-6-фосфа-та. Эритрозофосфат вместе с третьей молекулой рибулезо-5-фосфата также дает глюкозо-6-фосфат и ФГА. В целом процесс может быть суммирован в следующем виде:
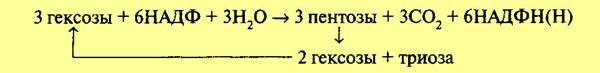
Триоза (ФГА) может претерпевать превращения по гликолитическому пути до пировиноградной кислоты и далее вступать в цикл Кребса. Как видно из уравнения, в пентозофосфатном цикле из каждых трех молекул глюкозы распадается одна, при этом выделяются 3 молекулы С02 и образуются 6 молекул НАДФН и ФГА. Окисление НАДФН идет через дыхательную цепь, при этом первоначально НАДФН взаимодействует с НАД. При включении 6 молекул НАДФН в дыхательную цепь образуется 18 молекул АТФ. Если считать, что 1 молекула АТФ используется на предварительное фосфорилирование гексозы, то накапливается 17 молекул АТФ. Вместе с тем при превращении фосфоглицеринового альдегида в пировиноградную кислоту и ее окислении через цикл Кребса образуется еще 20 молекул АТФ. Таким образом, при окислении по пентозофосфатному пути одной молекулы глюкозы выделяется 37 молекул АТФ. Следовательно, с энергетической стороны апотомический путь почти не отличается от гликолитического. Однако они сильно различаются по промежуточным продуктам. В процессе апотомического распада глюкозы образуется восстановленный НАДФ, который может быть использован на различные синтетические процессы, в том числе и в темновых реакциях фотосинтеза. Важное значение имеет образование пентоз. Пентозы входят в состав нуклеиновых кислот. Нельзя не отметить, что образующийся в этом процессе эритрозофосфат является предшественником лигнина и ряда других соединений.
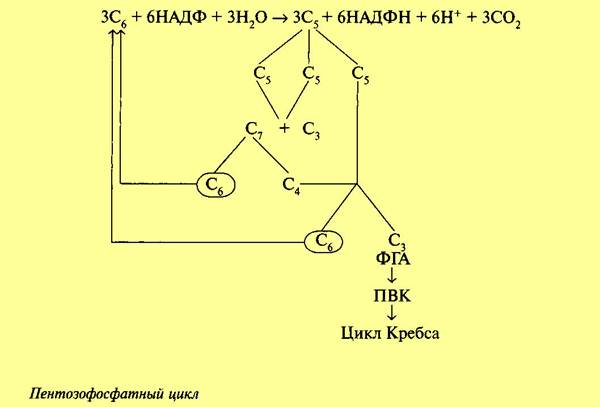
Внимательное рассмотрение реакций окисления глюкозы, связанных с пентозофосфатным путем, показывает его большое сходство с превращением углеводов в фотосинтетическом цикле Кальвина. Возможно, что благодаря наличию одинаковых промежуточных продуктов эти процессы в ряде пунктов взаимосвязаны. Интересно отметить, что наряду с локализацией пентозофосфатного пути в цитоплазме он может в отсутствие света осуществляться и в хлороплатах. На протяжении онтогенеза растений и в зависимости от условий происходит смена дыхательных путей. В силу образования различных промежуточных продуктов это оказывает значительное влияние на обмен веществ и физиологическую деятельность растительного организма. Существует ряд методов, с помощью которых можно установить соотношение путей дыхательного обмена (применение специфических ингибиторов, метод с использованием меченых атомов и др.). Однако все они имеют свои недостатки и в силу этого к экспериментальным данным по этому вопросу надо подходить с большой осторожностью
ГЛИОКСИЛАТНЫЙ ЦИКЛ
У многих растений, синтезирующих в качестве запасных веществ жиры, происходит дополнительный к циклу Кребса глиоксилатный цикл.
В этом процессе жирные кислоты сначала активируются в наружной митохондриальной мембране путем этерификации с образованием коферментА-эфиров. Эти эфиры превращаются затем в эфиры карнитина, которые могут проходить сквозь внутреннюю митохондриальную мембрану и попадать в матрикс, где снова превращаются в КоА-эфиры. Последовательное отщепление молекул ацетилКоА от КоА-эфиров жирных кислот называется b-окислением.
В глиоксилатном цикле ацетилКоА, также как и в цикле Кребса, вступает в реакцию с щавелевоуксусной кислотой, образуя лимонную кислоту, но в цепи дальнейших превращений разлагается на четырехуглеродное соединение (янтарную кислоту), которая уходит в цикл Кребса, и глиоксилевую кислоту, которая, соединяясь со второй молекулой ацетилКоА, образующегося при b-окислении жирной кислоты, превращается в щавелевоуксусную кислоту.
Физиологический смысл глиоксилатного цикла состоят в дополнительном пути разложения жиров И разнообразных промежуточных соединений, играющих важную роль в биохимических реакциях.
ФИЗИОЛОГИЧЕСКИЙ РОЛЬ МИКРОЭЛЕМЕНТОВ
Практическая значимость исследований по микроэлементам связана с тем, что есть почвенные провинции, где остро недостает того или иного из них. Кроме того, часто в почве микроэлементы находятся в неусвояемом для растительного организма состоянии, поэтому внесение микроудобрений (удобрений, содержащих микроэлементы) в почву очень полезно. Однако надо учитывать, что высокие дозы микроэлементов могут оказать ядовитое влияние. Выяснилось, что микроэлементы в подавляющем большинстве активируют определенные ферментативные системы. Это осуществляется различными путями — непосредственным участием в составе молекул ферментов или их активацией. Важным моментом в действии всех микроэлементов является их способность давать комплексные соединения с различными органическими соединениями, в том числе и с белками. Разные микроэлементы могут давать комплексные соединения с одними и теми же органическими веществами, благодаря чему они могут выступать как антагонисты. Отсюда понятно, что для нормального роста растений необходимо определенное соотношение микроэлементов (железа к марганцу, меди к бору и т. д.). В решение вопросов, связанных с питанием растений микроэлементами большой вклад внесли Я.В. Пейве, М.Я. Школьник, М.В. Каталымов, Б.А. Ягодин и др.
Марганец поступает в растение в виде ионов Мп2+. Среднее содержание марганца в растениях 0,001 %. В растении марганец находится в разной степени окисления (Мп2+, Мп3+, Мп4+). Марганец характеризуется высоким показателем окислительно-восстановительного потенциала. С этим связано значение этого элемента в реакциях биологического окисления. Он необходим для нормального протекания фотосинтеза, поскольку входит в состав активного центра кислородовыделяющего комплекса фотосистемы II и осуществляет разложение воды и выделение кислорода: 2Мп4++ 2Н20 -> 2Мп2++ 4Н++ 02. Кроме того, марганец участвует в восстановлении С02, играет роль в поддержании структуры хлоропластов. В отсутствие марганца хлорофилл быстро разрушается на свету. Марганец активирует более 35 ферментов, участвующих в реакциях окисления-восстановления, декарбоксилирования и гидролиза. В том числе ферменты, катализирующие реакции цикла Кребса (дегидрогеназа яблочной кислоты, лимонной кислоты, декарбоксилаза щавелевоуксусной кислоты и др.). В связи с этим понятно большое значение марганца для процесса дыхания, особенно его аэробной фазы. Марганец участвует в азотном обмене в восстановлении нитратов до аммиака, поскольку в этом процессе участвуют ферменты, некоторые из которых зависимы от марганца. В связи с этим у растений, испытывающих недостаток марганца, затруднено использование нитратов в качестве источника азотного питания. Марганец связан с синтезом белка через регуляцию активности ДНК-полимеразы и РНК-полимеразы. Марганец активирует ферменты, участвующие в окислении важнейшего фитогормона — ауксина. Медь поступает в растение в виде иона Сu2+или Сu+. Среднее содержание меди в растениях 0,0002%.
Медь входит непосредственно в состав ряда ферментных систем, относящихся к группе оксидаз, таких, как полифенолоксидаза, аскорбатоксидаза, цитохромоксидаза. В этих ферментах медь соединена с белком, по-видимому, через SH-группы. Полифенолоксидаза и аскорбатоксидаза осуществляют окисление фенолов и аскорбиновой кислоты, а цитохромоксидаза входит в состав дыхательной цепи митохондрий. Ряд ферментов медь активирует, в частности нитратредуктазу, а также протеазы. Это объясняет роль меди в азотном обмене. Большая часть меди (75% от всего содержания меди в листьях) концентрируется в хлоропластах. В хлоропластах сосредоточен и медьсодержащий белок синего цвета — пластоцианин. Содержание меди в пластоцианине составляет 0,57%. Медь, подобно железу и марганцу, обладает способностью к обратимому окислению и восстановлению: Сu2++ е —> Сu+. Именно поэтому пластоцианин участвует в переносе электронов от ФСII к ФСI. При дефиците меди снижается активность первой фотосистемы. В связи с этим понятно значение меди для процесса фотосинтеза.
Цинк поступает в растение в виде ионов Zn2+. Среднее содержание цинка в растениях 0,002%. В растениях цинк не участвует в окислительно-восстановительных реакциях, поскольку не меняет степень окисления. Он входит в состав более 30 ферментов, в т. ч. фосфатазы, карбоангидразы, алкогольдегидрогеназа, РНК-полимераза и др. Карбоангидраза катализирует разложение гидрата окиси углерода на воду и углекислый газ. Эта реакция важна для процесса фотосинтеза. Углекислый газ, поступая в клетку, растворяется в воде, образуя Н2С03: С02+ Н20 <-> НС03+ Н+. Фермент карбоангидраза, катализируя высвобождение С02из гидрата окиси углерода, способствует его использованию в процессе фотосинтеза. Кроме того, цинк активирует такие ферменты, как енолаза, альдолаза, гексокиназа, триозофосфатдегидрогеназа. В этой связи понятно значение цинка для процессов дыхания и фотосинтеза. Цинк играет важную роль при образовании фитогормона ауксина. Это связано с тем, что цинк, повышая активность триптофансинтетазы, влияет на образование аминокислоты триптофана — предшественника ауксина. Внесение цинка повышает содержание ауксинов и заметно сказывается на темпах роста растений. При дефиците цинка возрастает проницаемость мембран, что свидетельствует о роли этого элемента в структуре мембран, в поддержании их интеграции. Цинк влияет на белковый синтез, на активность РНКазы. Обнаружены белки, содержащие цинк и участвующие в репликации ДНК и транскрипции. Цинк входит в состав одного из факторов регуляции транскрипции в соединении с остатками гистидина и цистеина («цинковые пальцы»).
Молибден поступает в растения в виде аниона Мо042-. Содержание молибдена в растениях составляет 0,0005—0,002%.
Молибден входит в состав более 20 ферментов, выполняя при этом не только каталитическую, но и структурную функцию. Молибден вместе с железом входит в состав активного центра ферментного комплекса нитрогеназы в виде Mo-Fe-белок и участвует в фиксации азота атмосферы различными микроорганизмами. При недостатке молибдена происходят заметные изменения в азотном обмене растений — наблюдается уменьшение синтеза белка при одновременном падении содержания аминокислот и амидов. Нарушения в азотном обмене особенно проявляются на фоне питания растений нитратами. Это связано с тем, что молибден входит в активный центр фермента, восстанавливающего нитраты до нитритов,— нитратредуктазу. Нитратредуктаза — это флавопротеид, простетической группой которого является флавинадениндинуклеотид (ФАД). При восстановлении нитратов молибден действует как переносчик электронов от ФАД к нитрату, при этом N03-переходит в N02-, а Мо5+— в Мо6+. Образование нитратредуктазы является одним из немногих примеров адаптивного синтеза ферментов в растительном организме. Этот фермент образуется, когда в среде имеются нитраты и молибден. Активность нитратредуктазы возрастает в 10 раз и более при питании растений нитратами по сравнению с аммиаком, причем появление фермента происходит уже через 1—3 ч после внесения в среду нитратов.
По-видимому, молибден обладает и другими функциями, так как необходим растению и в условиях достаточного уровня аммиачного питания. При недостатке молибдена резко падает содержание аскорбиновой кислоты. При отсутствии молибдена наблюдаются нарушения в фосфорном обмене растений. Со способностью молибдена к комплексообразованию связано влияние этого элемента на стабилизацию структуры нуклеиновых кислот.
Бор поступает в растение в виде аниона борной кислоты — В033-. Среднее содержание бора в растениях 0,0001%. Роль бора выяснена далеко не достаточно. Это связано с тем, что бор, в отличие от большинства других микроэлементов, не входит в состав ни одного фермента и не является активатором ферментов. Большое значение для осуществления функции бора имеет его способность давать комплексные соединения. Комплексы с борной кислотой образуют простые сахара, полисахариды, спирты, фенольные соединения и др. В этой связи можно предположить, что бор влияет на скорость ферментативных реакций через субстраты, на которые действуют ферменты. Комплексы органических соединений с борной кислотой могут иметь и иное значение. Так, способность бора образовывать комплексы с углеводами оказывает влияние на клеточную оболочку, регулируя ориентацию мицелл целлюлозы, что способствует ее большей эластичности (Е.В. Бобко). У растений, испытывающих недостаток бора, наблюдается быстрая потеря эластичности клеточных оболочек, что, в свою очередь, связано с более жесткой ориентацией мицелл целлюлозы. Бор играет роль в поддержании структуры мембран. При недостатке бора подавляется аКтивность Н+-помпы, повышается проницаемость мембран.
Комплексы Сахаров с бором — сахаробораты, по-видимому, легче проникают через мембраны и быстрее передвигаются по растению. При недостатке бора сахара накапливаются в листьях, и их отток резко тормозится. Определения, проведенные с нанесением меченой сахарозы на листья, показали, что при небольшом добавлении борной кислоты отток сахарозы идет значительно быстрее. Сходные результаты были получены в опытах, в которых лист экспонировался в атмосфере, содержащей меченый С02. Образовавшиеся при этом меченые продукты фотосинтеза оттекали значительно быстрее у растений, получивших бор. Показано (М.Я. Школьник), что при недостатке бора нарушается синтез нуклеиновых кислот. В боронедостаточных растениях заторможен процесс аминирования органических кислот. Бор может выступать как ингибитор активности ряда ферментов, в первую очередь катализирующих образование фенольных соединений. При недостатке бора наблюдается накопление кофейной и хлорогеновой кислот, которые считаются ингибиторами роста растений. Бор усиливает рост пыльцевых трубок, прорастание пыльцы. В этой связи опрыскивание бором способствует оплодотворению.
Кобальт находится в тканях растений в ионной (Со2+, Со3+) и комплексной форме. Содержание кобальта в среднем составляет 0,00002%. Особенно кобальт необходим бобовым растениям, поскольку участвует в фиксации атмосферного азота. Кобальт входит в состав кобаламина (витамин В12и его производные), который синтезируется бактериями в клубеньках бобовых растений, а также в состав ферментов у азотфиксирующих организмов, участвующих в синтезе метионина, ДНК и делении клеток бактерий. При дефиците кобальта подавляется синтез леггемоглобина, снижается синтез белка, и уменьшаются размеры бактероидов. Это говорит в пользу необходимости кобальта. Установлена потребность в кобальте для высших растений, не способных к азотфиксации. Показано влияние кобальта на функционирование фотосинтетического аппарата, синтез белка, его связь с ауксиновым обменом. Трудность решения вопроса о необходимости кобальта для всех растений заключается в том, что потребность в нем чрезвычайно мала.
Хлор поступает в растение в виде Сl-. Хлор необходим для работы ФС II на этапе фотосинтетического разложения воды и выделения кислорода. Показано влияние хлоридов на работу Н+-АТФаз тонопласта, участие в делении клетки. Имеются сведения о влиянии хлора на азотный обмен. Так, хлориды стимулируют активность аспарагинсинтетазы, которая участвует в переносе аминогруппы на аспарагин. Концентрируясь в растении в вакуолях, хлориды могут выполнять осморегулирующую функцию. Недостаток хлора проявляется редко и наблюдается только на очень щелочных почвах.
Никель поступает в растения в виде иона Ni2+, но может также находиться в виде Ni+и Ni3+, Роль никеля для высших растений как микроэлемента была доказана недавно. До этого считали никель необходимым микроэлементом многих бактерий. У высших растений никель входит в состав фермента уреазы, который осуществляет реакцию разложения мочевины. Показано, что в растениях, обеспеченных никелем, активность уреазы выше и соответственно ниже содержание мочевины по сравнению с необеспеченными. Никель активирует ряд ферментов, в т. ч. нитратредуктазу и другие, оказывает стабилизирующее влияние на структуру рибосом. Имеются еще и такие элементы, которые усиливают рост лишь определенных групп растений.
Для роста некоторых растений засоленных почв (галофитов) оказывается полезным натрий. Необходимость натрия проявляется у растений С4и САМ. У этих растений показана необходимость натрия для регенерации ФЕП при карбоксилировании. Недостаток натрия у этих растений приводит к хлорозу и некрозам, а также тормозит развитие цветка. В натрии нуждаются и многие С3-растения. Показано, что этот элемент улучшает рост растяжением и выполняет осморегулирующую функцию, подобно калию. Благоприятное влияние оказывает натрий на рост сахарной свеклы и цианобактерий.
Для роста диатомовых водорослей необходим кремний. Он улучшает рост некоторых злаков, таких, как рис и кукуруза. Кремний повышает устойчивость растений против полегания, так как входит в состав клеточных стенок. Хвощи нуждаются в кремнии для прохождения жизненного цикла. Однако и другие виды аккумулируют достаточно кремния и отвечают при внесении кремния повЫшением темпов роста и продуктивности. В гидрированной форме Si02кремний накапливается в эндоплазматическом ретикулуме, клеточных стенках, в межклеточных пространствах. Он может также образовывать комплексы с полифенолами и в этой форме вместо лигнина служит для укрепления клеточных стенок. Показана необходимость ванадия для Scenedesmus (зеленая одноклеточная водоросль), причем это очень специфическая потребность, так как даже для роста хлореллы ванадий не нужен. Не все растения одинаково нуждаются и в тех элементах, которые относят к необходимым. Так, уже упоминалось, что бор значительно меньше нужен злакам. Бор и кальций необходимы для всех растений. В то же время для некоторых бактерий и грибов кальций может быть заменен стронцием или барием. Бобовые больше нуждаются в молибдене по сравнению с представителями других семейств. Калий в некоторых случаях и в небольших количествах может быть заменен рубидием или цезием. Бериллий может заменить магний для некоторых грибов и частично для томатов. Не все элементы, необходимые для жизни растений, являются таковыми для животных. Так, по-видимому, для животных не нужен бор. Они больше нуждаются в натрии, чем в калии. Установлено, что для животных необходимы йод и кобальт. Такие различия в реакции на элементы питания различных организмов для физиолога очень важны, так как дают возможность выяснить, какую роль играет данный элемент. Так, если бор не нужен животным, то, следовательно, его функция должна быть связана со специфическими особенностями растительного организма.
ГОРМОНЫ РОСТА РАСТЕНИЙ
Для многоклеточных организмов характерен тип регуляции, который связан с взаимодействием между отдельными клетками, тканями или даже органами. Для осуществления такой координации в организме вырабатываются гормоны. Гормоны растений получили название фитогормонов. Фитогормоны — это вещества, вырабатывающиеся в процессе естественного обмена веществ и оказывающие в ничтожных количествах регуляторное влияние, координирующее физиологические процессы. В этой связи к ним часто применяется термин — природные регуляторы роста. В большинстве случаев, но не всегда фитогормоны образуются в одних клетках и органах, а оказывают влияние на другие. Иначе говоря, гормоны способны к передвижению по растению и их влияние носит дистанционный характер. Большинство физиологических процессов, в первую очередь рост, формообразование и развитие растений, регулируется гормонами. Гормоны играют ведущую роль в адаптации растений к условиям среды. Известны следующие пять групп фитогормонов: ауксины, гиббереллины, цитокинины, абсцизовая кислота, газ этилен. В последнее время к ним относят брассины (брассиностероиды). Условно можно отнести первые три группы—ауксины, гиббереллины и цитокинины и частично брассины — к веществам стимулирующего характера, тогда как абсцизовую кислоту и этилен — к ингибиторам.
Ауксины — это вещества индольной природы. Основным фитогормоном типа ауксина является b -индолилуксусная кислота (ИУК). Открытие ауксинов связано с исследованиями Ч. Дарвина (1860). Дарвин установил, что, если осветить проросток злака с одной стороны, он изгибается к свету. Однако, если на верхушку проростка надеть непроницаемый для света колпачок и после этого поставить в условия одностороннего освещения, изгиба не происходит. Таким образом, органом, воспринимающим одностороннее освещение, является верхушка растения, тогда как сам изгиб происходит в нижней части проростка. Из этого Ч. Дарвин заключил, что в верхушке проростка под влиянием одностороннего освещения вырабатывается вещество, которое передвигается вниз и вызывает изгиб. Идеи Ч. Дарвина получили развитие лишь через 50 лет в работах датского исследователя П. Бойсен-Йенсена, который показал, что если срезанную верхушку вновь наложить на колеоптиль через слой желатины, то при одностороннем освещении наблюдается изгиб к свету. Было показано также, что удаление верхушки проростка (декапитация) резко замедляет рост нижележащих клеток, находящихся в фазе растяжения. При обратном накладывании верхушки проростка через слой желатина или агар-агара рост нижележащих клеток возобновляется. Далее исследования Вента показали, что, если срезанную верхушку поместить на блок из агар-агара, а затем наложить этот блок на декапитированный колеоптиль, рост возобновляется. Если агаровый блок, на котором в течение некоторого времени была помещена верхушка колеоптиля, наложить на обезглавленный колеоптиль асимметрично, то происходит изгиб, причем более интенсивно растет та сторона, на которую наложен блок. Все эти опыты привели к выводу, что в верхушке проростков вырабатывается особое вещество, которое, передвигаясь к нижележащим клеткам, регулирует их рост в фазе растяжения. Поскольку это вещество вырабатывается в одной части растения, а в другой вызывает физиологический эффект, оно было отнесено к гормонам роста растения — фитогормонам. Исследования, проведенные академиком Н.Г. Холодным, показали, что рост различных видов растений, а также различных органов одного и того же растения регулируется одним и тем же гормоном — ауксином. Оказалось, что фитогормоны типа ауксина — b-индолилуксусная кислота (ИУК) и некоторые близкие к ней соединения — широко распространены в растениях. Наиболее богаты ауксинами растущие части растительного организма: верхушки стебля, молодые растущие части листьев, почки, завязи, развивающиеся семена, а также пыльца. Образование ауксинов в большинстве случаев идет в меристематических тканях. Ауксины передвигаются из верхушки побега вниз к его основанию, а далее от основания корня к его окончанию. Таким образом, передвижение ауксинов полярно. Полярное передвижение ауксинов идет по проводящим пучкам со скоростью, значительно превышающей скорость обычной диффузии (5—10 мм/ч). Тем не менее, скорость передвижения ауксина по флоэме в 100 раз медленнее, чем ассимилятов. По-видимому, это активный процесс, требующий затраты энергии. Недостаток кислорода, торможение процесса дыхания с помощью различных ингибиторов приостанавливают передвижение ауксинов. Во взрослом дифференцированном растении при высокой концентрации гормона может наблюдаться и неполярное передвижение ауксинов вверх по растению с током воды по ксилеме.
Наиболее ярким проявлением физиологического действия ауксина является его влияние на рост клеток в фазе растяжения. ИУК стимулирует выход протонов в клеточную стенку и увеличивает ее растяжимость. Под влиянием оптимальной концентрации ИУК рост в длину декапитированных отрезков стеблей гороха увеличивается более чем в два раза. Ауксины в некоторых случаях стимулируют деление клеток, например камбия. Под влиянием ауксинов может измениться направление дифференциации клеток. Поданным Торрея, ауксин вызывает дифференциацию ксилемы, индуцирует корнеобразование. В последнее время эти данные получили подтверждение. Так, введение в растения петунии гена синтеза ауксинов из агробактерии индуцировало дифференциацию проводящих пучков. В тоже время после внедрения в растения табака гена, снижающего содержание ИУК, уменьшилось и число сосудов. Стимуляция ауксином роста боковых корней показана на мутантах арабидопсиса, у которых образование массы корней происходило на фоне в 17 раз большего накопления ауксина. Таким образом, все проявления роста клеток находятся в определенной зависимости от содержания природных ауксинов. Большую роль играют ауксины при разрастании завязи и плодообразовании. Показано, что ауксины могут синтезироваться в пыльце, зародыше, эндосперме. На первых стадиях роста плодов ауксин поступает из эндосперма, а позднее — из зародыша. У некоторых растений ауксин стимулирует образование бессемянных (партенокарпических) плодов. Ауксины, так же как и другие фитогормоны, обусловливают взаимодействие отдельных органов растения (коррелятивный рост). Ауксин обуславливает явление апикального доминирования, проявляющегося в подавляющем влиянии верхушечной почки на рост пазушных. Участие ауксина в этом процессе установлено в1935 г. Прямые определения показали, что через 4 часа после декапитации содержания ауксина в узлах увеличивалось в 5 раз. С участием ауксина связана также регуляция двигательной активности растений, в частности тропизмы и настии. Действие ауксина находится в зависимости от его концентрации. Повышение концентрации ауксина выше оптимальной вызывает торможение роста. При этом для разных растений и для неодинаковых органов оптимальная концентрация ауксина резко различна. Одна и та же концентрация его может усилить рост одних органов и затормозить другие. Так, оптимальная концентрация для роста стебля составляет около 10 мг, тогда как для корня всего 0,01 мг ИУК на 1 кг массы растения. Концентрация ауксинов, усиливающая рост злаков, резко тормозит рост многих двудольных растений. Это может быть связано с тем, что ауксин стимулирует синтез другого фитогормона, ингибирующего рост, а именно этилена.
При всех физиологических проявлениях ауксины усиливают поступление воды и питательных веществ (аттрагирующее влияние). Имеются многочисленные данные, что ауксины являются регуляторами притока воды и питательных веществ. Ауксины влияют на распределение питательных веществ в растении (Н.А. Максимов, Н.И. Якушкина). При внесении извне ауксинов или их синтетических аналогов они концентрируются в отдельных органах и клетках. Это вызывает приток к этим органам воды и питательных веществ и, как следствие, их усиленный рост. Одновременно рост других органов, содержащих меньше ауксинов, ослабляется, поскольку питательные вещества к ним поступают в меньшем количестве. Так, при обработке фитогормонами типа ауксина цветков томата происходит усиленное разрастание завязей, приток к ним питательных веществ значительно повышается, а рост боковых побегов тормозится. Общий вынос питательных веществ при этом не изменяется. Из этих опытов следует, что гормоны типа ауксина вызывают перераспределение питательных веществ в растении. В некоторых случаях ауксин может вызвать усиление притока питательных веществ и из внешней среды. Существуют разные гипотезы, объясняющие действие ауксина на передвижение веществ. Не вызывает сомнения, что транспорт веществ по растительному организму определенным образом связан с напряженностью энергетического обмена. В этой связи важно отметить, что еще в 1933 г. появились исследования, показывающие, что под влиянием ауксина интенсивность дыхания растет (Д. Боннер). В отсутствие кислорода действие ауксина или не проявляется, или значительно ослабевает. На различных объектах установлено, что влияние ауксина на повышение интенсивности дыхания опережает во времени его действие на ростовые процессы. Под влиянием ИУК возрастает сопряженность окисления и фосфорилирования (коэффициент Р/О) и содержание в клетках АТФ. Это дает основание считать, что ИУК увеличивает энергетическую эффективность дыхания растений (Н.И. Якушкина, И.А. Кулакова). Под влиянием ИУК возрастает и энергетический заряд клетки (отношение АТФ + АДФ к АМФ). Известно, что даже небольшие сдвиги в энергетическом потенциале клетки приводят к заметным изменениям в скорости различных ферментативных реакций. Положительные сдвиги в энергетическом обмене вызывают усиление передвижения питательных веществ и воды, что является одной из причин усиления роста растений. Решение вопроса о причинах усиления образования АТФ под влиянием ИУК связано с изучением первичных механизмов регуляторного влияния этого фитогормона.
Открытие гормонов растений гиббереллинов связано с изучением болезни риса. В юго-восточных странах, в частности в Японии, распространена болезнь риса «баканэ», или болезнь дурных побегов. У растений, пораженных этой болезнью, вытянутые бледные побеги. Японские ученые показали, что эта болезнь вызывается выделением гриба Gibberella fujikuroi. Из выделений этого гриба было получено кристаллическое вещество — гиббереллин. В дальнейшем выяснилось, что гиббереллины — широко распространенные среди растений вещества, обладающие высокой физиологической активностью и являющиеся, подобно ауксинам, естественными фитогормонами. В настоящее время известно более 80 веществ, относящихся к группе гиббереллинов и обозначающихся номерами: ГА1ГА2и др. Не все гиббереллины обладают физиологической активностью. По химической структуре это производные дитерпенов — дитерпеноиды, состоящие из четырех изопреновых остатков. Наиболее распространенный гиббереллин А3— гибберелловая кислота (ГК). Остальные гиббереллины различаются в основном по структуре боковых цепочек. Растения на разных этапах онтогенеза могут различаться по набору гиббереллинов, активность которых может быть различной. Гиббереллины могут образовываться в разных, по преимуществу растущих частях растительного организма. Все же основное место синтеза гиббереллинов — это листья. Имеются данные, что гиббереллины образуются в пластидах. По-видимому, гиббереллины существуют в двух формах — свободной и связанной. Нередко наблюдаемое повышение содержания гиббереллинов связано с переходом их из связанной в свободную (активную) форму. Так, гиббереллины способны связываться с сахарами, например с глюкозой. Образующиеся гиббереллингликозиды накапливаются главным образом в семенах. В отличие от ауксинов гиббереллины передвигаются из листьев как вверх, так и вниз, как по ксилеме, так и по флоэме. Это пассивный процесс, не связанный с метаболизмом. Образование гиббереллина в хлоропластах идет путем превращения мевалоновой кислоты в геранилгераниол и далее через каурен в гибберелловую кислоту. Мевалоновая кислота является предшественником как гиббереллина и цитокинина, так и важнейшего природного ингибитора роста — абсцизовой кислоты. Показано, что существует другой путь синтеза гиббереллинов, не зависящий от мевалоновой кислоты и локализованный в цитоплазме. Внешние условия оказывают влияние на образование и содержание гиббереллинов в растении. Во многих случаях под влиянием одного и того же внешнего фактора содержание ауксинов и гиббереллинов изменяется противоположным образом. Так, освещение увеличивает содержание гиббереллинов и уменьшает содержание ауксина. Большое влияние на содержание гиббереллинов оказывает качество света. При выращивании растений на красном свете в них содержится больше гиббереллинов по сравнению с выращиванием на синем свете.
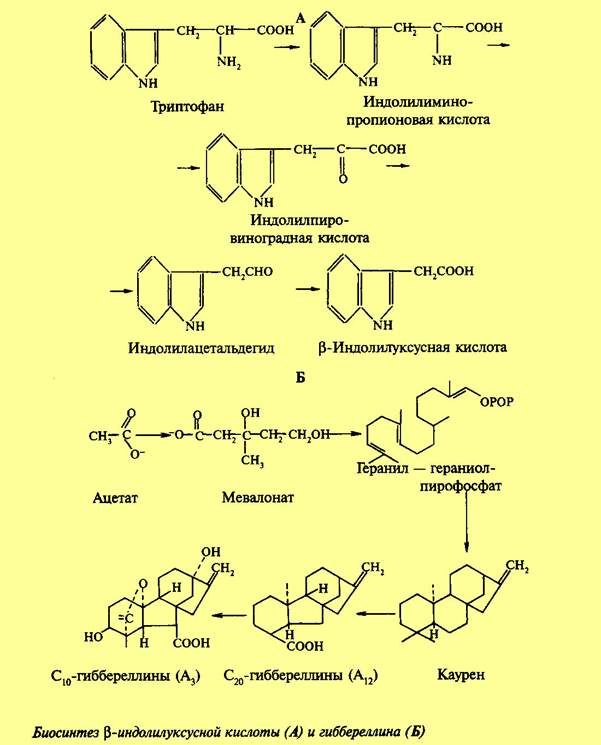
Улучшение питания растений азотом увеличивает содержание ауксинов, а содержание гиббереллинов при этом снижается. Противоположные изменения в содержании ауксинов и гиббереллинов позволяют предполагать, что и в образовании этих двух фитогормонов имеется общий предшественник. Им может быть ацетил-КоА. При его участии образуется как мевалоновая, так и b -кетоглутаровая кислота. Последняя является одним из предшественников при образовании ауксина через триптофан. В некоторых случаях наблюдается одновременное падение содержания как ауксинов, так и гиббереллинов. Так, уменьшение влажности почвы, выращивание растений в стерильных условиях снижают содержание как того, так и другого фитогормона. Содержание гиббереллинов меняется в процессе онтогенеза растительного
 2013-12-31
2013-12-31 725
725








