Система, в которой определена температура (как один из параметров состояния), является термодинамической системой. Это утверждение может считаться «нулевым» началом термодинамики.[4]
 Определение температуры базируется на понятии теплового равновесия термодинамической системы и его транзитивности.
Определение температуры базируется на понятии теплового равновесия термодинамической системы и его транзитивности.
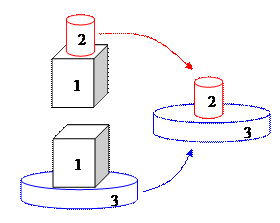
В общем виде равновесие двух термодинамических систем, находящихся в тепловом контакте определяется некоторой функцией набора параметров двух систем
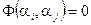 .
.
В соответствии со схемой транзитивности можно записать
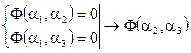
Можно показать, что этой схеме уравнений удовлетворяет только «разностный» вид функции
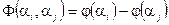
Или
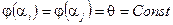 .
.
Отсюда следует уравнение
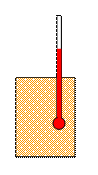
 ,
,
которое является уравнением равновесия термодинамической системы. Тепловое равновесие двух систем определяется равенством для этих систем параметров q. Этот параметр q и можно принять за меру температуры. Измерение температуры осуществляется термометром – малой термодинамической системой, которую приводят в тепловой контакт с измеряемой системой. Для построения шкалы температур можно использовать любой параметр «термометра», который является функцией температуры.
Считается, что для логического определения температуры замкнутой системы она (система) должна быть макроскопической (состоять из большого числа «частиц»[5]) и быть равновесной.[6] Температура является скалярным, интенсивным параметром[7]. В равновесной термодинамической системе температура должна быть постоянной по всему объему. Температура определяет внутреннюю энергию системы и с точки зрения статистической термодинамики определяет вероятность состояния системы. В соответствии со сказанным приведем следующие формулы:
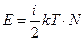 - энергия идеального газа (i – число степеней свободы «частицы» идеального газа, N – число частиц).
- энергия идеального газа (i – число степеней свободы «частицы» идеального газа, N – число частиц).
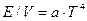 - закон Стефана-Больцмана (плотность энергии равновесного теплового излучения).
- закон Стефана-Больцмана (плотность энергии равновесного теплового излучения).
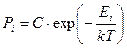 - вероятность системы, погруженной в термостат находится в i -ом квантовом состоянии. Ei – энергия этого состояния. В этих формулах T – температура по шкале Кельвина.
- вероятность системы, погруженной в термостат находится в i -ом квантовом состоянии. Ei – энергия этого состояния. В этих формулах T – температура по шкале Кельвина.
2. Первый закон термодинамики (первое начало). Химический потенциал.
Первый закон термодинамики записывают в виде
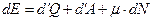
Энергию системы можно изменить тремя способами. Сообщить тепло, совершить над системой работу и добавить число частиц.[8] В третье слагаемое входит величина m, называемая химическим потенциалом. В соответствии с формулой
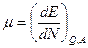 .
.
Химический потенциал численно равен удельному изменению энергии в условиях отсутствия теплообмена и работы.[9]
3. Второй закон термодинамики (второе начало).
«Невозможен процесс, единственным конечным результатом которого будет превращение в работу теплоты, извлеченной из источника, имеющего всюду одинаковую температуру». (Постулат Кельвина, невозможность вечного двигателя второго рода.)
«Невозможен процесс, единственным конечным результатом которого был бы переход теплоты от тела с данной температурой к телу с более высокой температурой». (Постулат Клаузиуса.)
4.
 |
Термодинамическая температура (шкала).
Абсолютная термодинамическая шкала температур строится на основе циклического процесса.
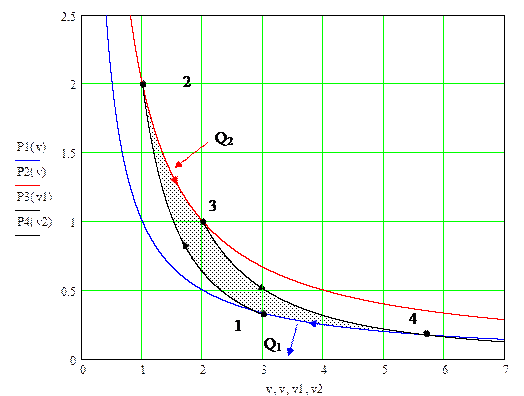
Здесь показан точный график цикла Карно с условными параметрами Т 2 = 2, Т 1 = 1, R = 1. В ходе цикла на участке 2 – 3 принимается теплота Q 2 от источника при температуре Т 2, на участке 4 – 1 отдается количество теплоты Q 1 системе имеющей температуру Т 1.
Можно показать что, для равновесного цикла Карно величина отношения теплот цикла является функцией только температур и не зависит от «рабочего тела» тепловой машины.
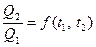 . (1)
. (1)
 Здесь t – температура, определяемая по произвольной шкале температур. Определим вид функции
Здесь t – температура, определяемая по произвольной шкале температур. Определим вид функции 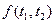 . Для этого рассмотрим циклы между тремя температурами. В соответствии с формулой (1) записываем
. Для этого рассмотрим циклы между тремя температурами. В соответствии с формулой (1) записываем
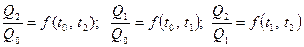 .
.
Считаем, что в первом и втором циклах «теряется» одно и тоже количество теплоты Q0. Из полученных трех отношений получаем
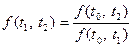
Эта формула будет справедливой, если функция 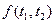 является функцией отношения двух одинаковых функций, но с различными значениями переменных
является функцией отношения двух одинаковых функций, но с различными значениями переменных
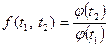 .
.
Универсальную неизвестную функцию j(t) (с точностью до константы) можно считать абсолютной термодинамической температурой
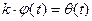 .
.
В этом случае отношение теплот цикла будет равно отношению термодинамических температур
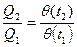 .
.
 2014-01-25
2014-01-25 1035
1035
