Признаки теплового равновесия. Температура
Тепловое равновесие газа
При тепловом равновесии потоки энергии и вещества через любую площадку отсутствуют (вернее, поток с одной стороны площадки равен потоку с другой). Образная картина равновесного состояния макроскопической системы выглядит так: физическая система находится в тепловом равновесии, если все, что могло остыть, остыло; все, что могло нагреться, нагрелось; все что могло перемешаться, перемешалось; все, что могло сломаться, сломалось и т.д.
В состоянии теплового равновесия температуры в каждой точке тела одинаковы. Рассмотрим термодинамическое определение температуры. В термодинамике, то есть науке о тепловых явлениях, которая не основана на молекулярных представлениях, температура является первичным понятием и определяется перечислением свойств, аналогично тому, как в механике определяется масса, в электричестве определяется заряд и т.п.
Температура - физическая величина, характеризующая состояние теплового равновесия термодинамической системы и обладающая следующими свойствами: если две взаимодействующие части системы имеют одинаковые температуры, то поток тепловой энергии между этими частями отсутствует; если две части системы имеют разные температуры, то имеет место поток энергии от части с большей температурой к части с меньшей температурой
Понятно, что величин, обладающих перечисленными выше свойствами, можно набрать бесчисленное множество. Это отразилось в большом числе температурных шкал, которыми пользовались физики на заре развития термодинамики: шкала Цельсия, шкала Реомюра, шкала Фаренгейта, шкала Кельвина и т.д. Температуры в термодинамике первоначально вводили эмпирическим путем. Подбирали какую-либо измеримую физическую характеристику термометрического тела (термометрический параметр), обладающую свойствами температуры. Например, объем газа при постоянном давлении, сопротивление проволоки и т.п. Сравнение температур различных тел проводилось путем сравнения значений термометрического параметра малого термометрического тела, приведенного в тепловой контакт с изучаемыми термодинамическими системами.
2.2.1 Рассмотрим столкновение двух молекул, имеющих массы m1 и m2. Обозначим скорость молекул до столкновения 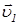 и
и 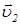 , а скорости после столкновения
, а скорости после столкновения 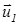 и
и 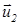 . Нас интересует, энергия, передаваемая от одной молекулы к другой в результате столкновения.
. Нас интересует, энергия, передаваемая от одной молекулы к другой в результате столкновения.
Изменение кинетической энергии первой частицы в результате столкновения равно минус изменению кинетической энергии второй частицы. Также равны изменения импульсов частиц:
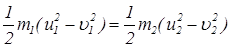 и
и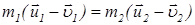 . (21)
. (21)
Из уравнений (21) следует, что
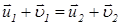 . (22)
. (22)
[Полезно воспользоваться формулой
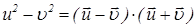 .] (23)
.] (23)
Используя закон сохранения импульса и выражение (22), исключим из них 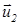 , так чтобы выражение для
, так чтобы выражение для 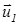 содержало только начальные скорости молекул
содержало только начальные скорости молекул 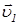 и
и 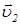 . Имеем:
. Имеем:

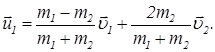 (24)
(24)
Изменение энергии молекулы -
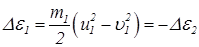 - (25)
- (25)
в результате столкновения равно:
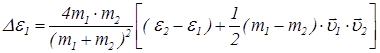 , (26)
, (26)
где 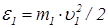 ,
, 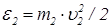 – начальные значения энергии молекул. При столкновении одинаковых молекул формула (26) принимает особенно простой вид
– начальные значения энергии молекул. При столкновении одинаковых молекул формула (26) принимает особенно простой вид
De=e1-e2 - (27)
молекула получает энергию, если сталкивается с более энергичной молекулой, и отдает, если сталкивается с менее энергичной.
Разумеется, молекула находится в непрерывном беспорядочном процессе передачи и получения энергии от других молекул.
2.2.2 Пусть рассмотренные выше две молекулы находятсясреди других молекул в газе, находящемся в состоянии теплового равновесия. В состоянии теплового равновесия энергия любой молекулы в среднем постоянна, то есть, в частности, 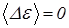 . Начальные скорости всех молекул должны иметь беспорядочные направления, так что косинус угла между
. Начальные скорости всех молекул должны иметь беспорядочные направления, так что косинус угла между 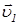 и
и 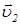 будет положительным также часто, как и отрицательным, то есть
будет положительным также часто, как и отрицательным, то есть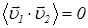 . Таким образом, из (26) следует, что в состоянии равновесия
. Таким образом, из (26) следует, что в состоянии равновесия 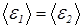 вне зависимости от соотношения масс молекул. Этот важный результат показывает, что средние кинетические энергии как одинаковых так и разных молекул в веществе одинаковы.
вне зависимости от соотношения масс молекул. Этот важный результат показывает, что средние кинетические энергии как одинаковых так и разных молекул в веществе одинаковы.
2.2.3 Из рассмотрения обмена энергией между молекулами газа, находящегося в тепловом равновесии видно, что средняя кинетическая энергия молекул обладает первым свойством температуры: “Если две части системы имеют одинаковые средние кинетические энергии, то передача энергии между этими частями отсутствует”. Можно показать, что средняя кинетическая энергия молекул обладает и вторым свойством температуры. Для этого рассмотрим сосуд, разделенный на две части теплоизолирующей перегородкой. В одном отсеке находится газ, молекулы которого имеют среднюю кинетическую энергию á e1 ñ, в другом - á e2 ñ (при одном и том же давлении). Пока перегородка на месте, газ в обоих отсеках находится в тепловом равновесии. Каждая молекула одинаково часто отдает и принимает энергию при соударениях с другими молекулами. Допустим, á e1 ñ > á e2 ñ. Если перегородку убрать, то, помимо соударений молекул с одинаковыми средними кинетическими энергиями, будут иметь место соударения молекул с разными средними кинетическими энергиями. При соударениях этого типа молекулы со средней энергией á e1 ñ чаще отдают, чем получают энергию. Имеет место передача энергии от части с большей средней кинетической энергией к части с меньшей средней кинетической энергией. Отсюда следует, что средняя кинетическая энергия молекул обладает и вторым свойством температуры. Таким образом, средняя кинетическая энергия может служить термометрическим параметром, причем этот параметр не зависит от рода термометрического вещества и в этом смысле является универсальным. Шкала, в которой температура измеряется в джоулях, называется универсальной (или энергетической) шкалой температур.
Температура Т в исторически выбранных единицах, измеряемая в кельвинах, и температура в энергетической шкале, если газ является одноатомным, связаны соотношением
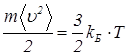 , (28)
, (28)
где kБ – постоянная Больцмана. Она равна kБ=1,38·10-23Дж/К.
Проведенный выше анализ не налагает на участвующие в теплообмене частицы никаких ограничений. Это могут быть и молекулы с сильно отличающимися массами и макроскопические (броуновские) частицы. Поскольку средние кинетические энергии молекул в состоянии теплового равновесия одинаковы, легкие частицы движутся быстрее, чем тяжелые. Из уравнения (28) следует:
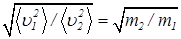 . (29)
. (29)
Например, в смеси кислорода O2 и водорода H2 находящиеся в тепловом равновесии молекулы водорода имеют среднеквадратичную скорость в четыре раза большую среднеквадратичной скорости молекул кислорода. Этот эффект, в частности, используется при разделении смеси изотопов.
Рассмотрим пример.
Задача. Сосуд разделен перегородкой на две части. Перегородка пористая и содержит огромное число тонких щелей. Газ, проникающий через щели, откачивается и собирается в специальную камеру. Левая часть сосуда заполняется разреженным газом из молекул с массами m1 и m2. Обозначим через c1 и c2 относительные концентрации молекул первого и второго типов соответственно. Эти концентрации поддерживаются постоянными в левой части сосуда из-за притока свежего газа в количестве, необходимом для компенсации утечки.
а) Обозначим через 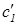 и
и 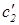 концентрации молекул обоих типов в откачиваемой камере. Чему равно отношение
концентрации молекул обоих типов в откачиваемой камере. Чему равно отношение 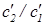 ?
?
б) Метод прогонки газообразного фтористого урана UF6 через пористую перегородку используют для обогащения смеси легким изотопом урана 235U. Газ в сосуде состоит из молекул 235U19F6 и 238U19F6 (начальные концентрации этих молекул соответствуют естественной распространенности обоих изотопов урана в природе и равны c238=99,3% и c235=0,7%). Найдите отношение 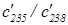 для молекул, собранных в камере после просачивания. Выразите это отношение через начальное отношение концентраций.
для молекул, собранных в камере после просачивания. Выразите это отношение через начальное отношение концентраций.
Решение. Проведем расчет числа молекул, попадающих в отверстия перегородки за время Dt. Рассмотрим процесс пролета газа через отверстия, размеры которых много меньше длины свободного пробега молекул. Эта ситуация интересна следующими факторами: выход молекул из сосуда не изменяет распределения их по скоростям, в отверстии скорости молекул такие же, как и в сосуде, в отличие от того, что получается при выходе газа через большое отверстие. В первом случае истечение газа называют эффузионным, во втором - гидродинамическим. При гидродинамическом истечении макроскопические области газа под действием разности сил давления от примыкающих областей приобретают скорость как целое.
Поскольку других молекул, проникающих через перегородку, не существует, то относительные концентрации молекул, собирающихся в специальном резервуаре за время Dt, будут равны
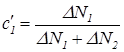 ,
, 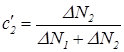 . (30)
. (30)
Расчет чисел DN1 и DN2 можно проводить на двух различных уровнях строгости. Менее строгий простой расчет игнорирует разброс молекул по скоростям. Он дает
DN1=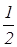 n1S v x1Dt, (31)
n1S v x1Dt, (31)
DN2=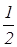 n2S v x2Dt, (32)
n2S v x2Dt, (32)
где n1 и n2 - объемные плотности молекул массами m1 и m2 соответственно, S - суммарная площадь отверстий в перегородке. В качестве v x1 и v x2 естественно взять среднеквадратичные значения проекции скорости. Они могут быть выражены через средний квадрат модуля скорости из очевидного соотношения
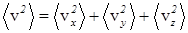 . (33)
. (33)
Поскольку в состоянии теплового равновесия
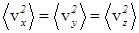 , (34)
, (34)
из уравнения (33) следует:
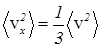 (35)
(35)
С учетом уравнения
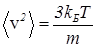 , (36)
, (36)
получаем:
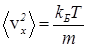 . (37)
. (37)
Подставляем соответствующие выражения DN1 и DN2 в уравнение (30)
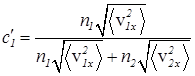
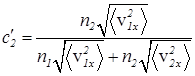 . (38)
. (38)
Учтем, что
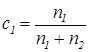 ,
, 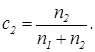 (39)
(39)
и учтем соотношение (37), тогда
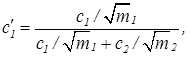
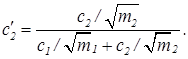 (40)
(40)
Соответственно
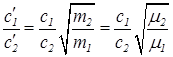 . (41)
. (41)
б) Подстановка значений c1, c2 и m1, m2 в формулу (41) дает:
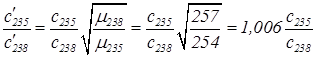 .
.
Данный результат говорит, что однократная прогонка фтористого урана через пористую перегородку весьма незначительно повышает концентрацию 235U (всего на 0,6%). Метод прогонки можно использовать для промышленного обогащения урана. Надо проводить многократное обогащение вновь получаемой смеси. Так, если провести череду последовательных обогащений путем последовательной прогонки, допустим через 56 специальных камер, концентрация 235U повышается едва не в 5 раз. Именно таким образом на некоторых обогатительных фабриках осуществляется обогащение урана.
Можно теперь применить полученные в данном разделе результаты для выражения коэффициента диффузии (20) через макроскопические параметры:
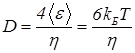 . (42)
. (42)
 2014-02-09
2014-02-09 4313
4313
