Термодинамика реакций высокотемпературного синтеза
Лекция 2
Задачи.
Энергия Гиббса.
Самопроизвольно, т. е. без затраты работы извне, система может переходить только из менее устойчивого состояния в более устойчивое. В химических процессах одновременно действуют две тенденции: стремление частиц объединяться за счет прочных связей в более сложные, что уменьшает энтальпию системы, и стремление частиц разъединиться, что увеличивает энтропию. Иными словами, проявляется действие двух прямо противоположных факторов - энтальпийного (DН) и энтропийного (TDS). Суммарный эффект этих двух противоположных тенденций в процессах, протекающих при постоянных Т и р, отражает изменение энергии Гиббса G (или изобарно-изотермического потенциала):
DG = DH - TDS
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса. Условием принципиальной возможности процесса является неравенство
DG < 0.
Увеличение энергии Гиббса
DG > 0
свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях. Если же DG = 0, то система находится в состоянии химического равновесия.
В соответствии с уравнением
DG = DH - TDS
самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии, т.е. когда DH < 0 и DS > 0.
Процессы, протекающие с уменьшением энтальпии (DH < 0) и увеличением энтропии (DS > 0), практически необратимы.
Изменение энергии Гиббса, как и изменение энтальпии и энтропии системы, не зависит от пути процесса. Поэтому для реакции вида
аА + bВ + • • • = dD + еЕ + • • •
изменение стандартной энергии Гиббса DG° равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
DG° = SDG°f, прод - SDG°f, исх.
При пользовании значениями стандартной энергии Гиббса критерием принципиальной возможности процесса в нестандартных условиях следует принять условие DG° < 0, а критерием принципиальной невозможности осуществления процесса - неравенства DG° > 0. Разумеется, если DG° == 0, то это вовсе не означает, что в реальных условиях система будет находиться в равновесии.
Во многих случаях значениями DG° можно пользоваться лишь для приближенной оценки направления реакций.
Термодинамика химических реакций получила быстрое развитие, в особенности после того, как на её основе был решен ряд важных технологических задач: синтез аммиака, синтез метанола, создание новых и совершенных металлургических процессов.
В настоящее время экспериментально измерены термодинамические свойства очень многих веществ и термодинамические параметры химических реакций. Это приводит к качественно новым возможностям - на основе справочных данных расчёт путём определения положения равновесия, тепловых эффектов и других термодинамических параметров для большинства числа реакций, не прибегая к непосредственному экспериментальному определению этих величин, которое более трудоёмко, более длительно и не всегда доступно.
Особенно важно, что такие расчеты позволяют дать сравнительную оценку и найти оптимальные условия проведения реакции.
Применение термодинамических методов для исследования химических реакций дает возможность установить:
§ Какие реакции при заданных температуре, давлении и концентрациях могут протекать самопроизвольно.
§ Каково положение равновесия.
§ Как изменить условия, чтобы процесс протекал в нужном направлении или в требуемой степени
§ Каковы тепловые эффекты химического взаимодействия и фазовых переходов.
Весьма ценно, что термодинамические параметры реакции не зависят от масштаба её проведения и поэтому их определение облегчает переход от результатов лабораторного изучения к производственным масштабам.
Этапы перехода к производственным масштабам:
1. Исследовательская работа в лабораторных масштабах.
2. Препаративные синтеза (100 г, кг).
3. Исследования на укрупненной лабораторной установке.
4. Исследование на полупромышленной установке.
5. Пилотная установка (прототип промышленной установки, предназначенный для изменений).
6. Промышленная установка.
7. Серийная промышленная установке.
Термодинамические параметры реакций определяются термодинамическими свойствами веществ, участвующих в реакции. Важнейшими из них являются:
U - внутренняя энергия
Н - энтальпия
S - энтропия
Ср - теплоемкость при постоянном давлении
F = U - TS - изохорно-изотермический потенциал (энергия Гельмгольца)
G = H - TS - изобарно-изотермический потенциал (энергия Гиббса)
µi - химический потенциал
За счет подвода тепла извне температура изменяется, причем приращение температуры зависит от физико-химических свойств системы.
Для характеристики этой зависимости вводят понятие теплоемкость:
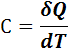
При V = const (изохорный процесс) из соотношений
dQ = dU + pdV и dQ = dU
следует 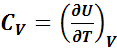
Для изобарного процесса (p = const), т.к. dQ = d(U + pV) = dH
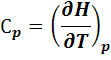
Через теплоемкость можно выразить количество тепла, выделенного или поглощенного системой:
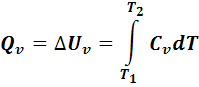
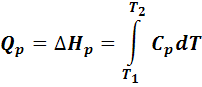
Величины СV и СР зависят от природы и агрегатного состояния вещества и изменяются с изменением температуры.
Для многих веществ эта зависимость исследована экспериментально и может быть выражена аналитически, т.е. в виде формулы. В справочниках по термодинамике эта зависимость дается в виде степенного ряда СР = а + bT + cT2 + dT-2.
Постоянные a, b, c, d определяются либо экспериментально, либо путем теоретического или полуэмпирического приближения. Коэффициенты c и d или оба могут отсутствовать.
Параметры состояния и характеристические
термодинамические функции
Термодинамическая характеристика системы задаётся её термодинамическими потенциалами или характеристическими термодинамическими функциями. Это название подчеркивает, что все термодинамические функции могут быть выражены через характеристическую функцию и её производные, взятые по соответствующим данной функции параметрам состояния или независимым переменным.
В качестве характеристических выбираются несколько функций, обычно U (внутренняя энергия), H (энтальпия), F (энергия Гельмгольца), G (энергия Гиббса).
Соответственно выбираются параметры состояния. Связь параметров состояния с соответствующими термодинамическими потенциалами рассматривается в курсе физической химии. Мы приведем лишь схему взаимосвязи U, H, F, G с параметрами p, V, S, T:



 P V
P V



 S T
S T
 2014-01-25
2014-01-25 984
984








