По изменению △ U и △ S нельзя оценить величину производимой работы,их начальных и конечных значений. Для этого и вводят термодинамическиепотенциалы, которые выводятся из объединенной записи первого и второгозаконов термодинамики.
Объединенная запись первого и второго начала термодинамики:
dQ=TdS
TdS= dU+dA
dU = TdS - dA
| Постоянные параметры | Название потенциала | Вид функции |
| V, S | Внутренняя энергия – изохорно-изоэнтропийный | U=ТS –рV |
| P, S | Энтальпия – изобарно-изоэнтропийный | H=U+pV |
| T, V | Свободная энергия Гельмгольца – изохорно-изотермический | F=U-TS |
| T, P | Термодинамический потенциал Гиббса – изобарно-изотермический | G=U+pV-TS |
В биологических системах процессы обычно сопровождаются так же изменением количества вещества и в таком случае:
Ø для незаряженных частиц (растворов неэлектролитов) используется химический потенциал: 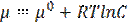 ,
,
Ø для заряженных частиц (растворов электролитов) – электрохимический потенциал: 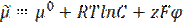
Тогда термодинамические потенциалы запишутся:
U=ТS –рV+ μdN
dG =- SdT +Vdp +μdN.
dF=dU-TdS+ μdN
Химический потенциал равен изменению термодинамического потенциала, приходящегося на одну частицу вещества в соответствующем процессе. ∆G=m∙∆μ, где m – количество вещества (моли) в системе.
Он не является термодинамическим потенциалом и служит параметром системы.
В физико-химических системах изменение свободной энергии обычно описывают через изменение электрохимического потенциала (∆μ): ∆G=m∙∆μ, где m – количество вещества (моли) в системе.
Физический смысл электрохимического потенциала заключается в том, что его изменение равно работе, которую необходимо затратить, чтобы:
1. синтезировать 1 моль вещества (состояние 2) из исходных веществ (состояние 1) и поместить его в растворитель (слагаемое μ02-μ01) – химическая работа;
2. сконцентрировать раствор от концентрации с1 до с2 [слагаемое RT ln (c2/c1)] – осмотическая работа;
3. преодолеть силы электрического отталкивания, возникающие при наличии разности потенциалов (φ2-φ1) между растворами [слагаемое zF (φ2-φ1] – электрическая работа.
Необходимо отметить, что слагаемые могут быть как положительными, так и отрицательными.
 2014-01-25
2014-01-25 838
838








