Вода диссоциирует по уравнению H2O ↔ H+ +OH-. Константа ее диссоциации равна: K= [H+][OH-] / [H2O ] Вода — очень слабый электролит, поэтому концентрация [Н20] остается практически постоянной при диссоциации, а следовательно, остается постоянной и величина Kw= [H+][OH-] которая называется ионным произведением воды.
Ионное произведение воды - произведение концентрации ионов водорода и ионов гидроксида в воде.
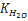 =
= 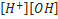 =
= 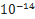
На практике для удобства используют водородный показатель (рН) и гидроксильный показатель (рОН) среды. Это есть взятый с обратным знаком десятичный логарифм концентраций (активностей) соответственно ионов водорода или гидроксильных ионов в растворе: рН = - lg[H+], рОН = - lg[OH-]
В водных растворах рН + рОН = 14.В щелочной среде рН>7; в кислой рН<7; в нормальной среде рН=7
7.Степень диссоциации (а) электролита как количественная характеристика равновесия процесса ионизации. Деление электролитов на сильные и слабые по величине степени диссоциации. Факторы, влияющие на степень диссоциации.
Электролитическая диссоциация - это процесс распада электролитов на ионы при растворении или расплавлении.
Электролиты - это те соединения, которые распадаются при растворении, расплавлении в воде, щелочах, кислоте.
Слабые электролиты - это химические соединения, молекулы которых в сильно разбавленных растворах незначительно диссоциируют на ионы. Слабыми электролитами являются: почти все органические кислоты и вода; некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H2CO3, H2SiO3, H2SO3 и др.; некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1.К сильным электролитам относятся: растворимые соли; некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr; HI); гидроксиды щелочных и щёлочноземельных металлов (NaOH, KOH, Ba(OH)2)
Степень диссоциации - процесс распада молекул в растворе или расплаве электролита на ионы называется электролитической диссоциацией. Одновременно в электролите протекают процессы ассоциации ионов в молекуле. При неизменных внешних условиях (температура, концентрация и др.) устанавливается динамическое равновесие между распадами и ассоциациями. Поэтому в электролитах диссоциирована определённая доля молекул вещества. Для количественной характеристики электролитической диссоциации было введено понятие степени диссоциации. Формула: 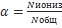
8. Константа диссоциации как константа равновесия процесса диссоциации. Показатель константы диссоциации (pK).
Константа диссоциации представляет собой константу равновесия процесса диссоциации слабого электролита и не зависит от концентрации растворенного вещества в растворе. Значения величин констант диссоциации для ряда электролитов приведены в таблице.
Например, циановодородная (синильная) кислота, является слабым электролитом. Как любая кислота она диссоциирует с образованием катионов водорода и анионов кислотного остатка:
HCN D H+ + CN-
Равновесие этого процесса характеризуется соответствующей константой диссоциации.
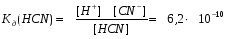
Малая величина константы диссоциации позволяет судить о незначительном распаде кислоты на ионы и смещении равновесия процесса диссоциации влево.
Равновесие процесса диссоциации в водном растворе такого вещества, как гидроксид аммония, можно представить следующим образом:
NH4OH D NH4+ + OH-
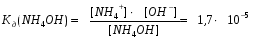
Чем меньше величина константы диссоциации электролита, тем он слабее. Ориентируясь на значение величины константы диссоциации можно делать заключение о силе электролита.
В качестве безразмерного показателя принята переменная величина, названная логарифмическим коэффициентом ионизации слабого электролита, pК. Эта величина pК равна отрицательному десятичному логарифму значения концентрации (моль / л) ионов слабого электролита:pK = – lg K.
 2018-03-09
2018-03-09 141
141








