Второй закон термодинамики в дифференциальной форме:
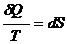
Применим уравнение к изобарному процессу (р = const).
Для 1 моль вещества
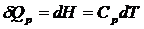 ;
;
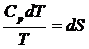 .
.
При нагревании вещества от температуры Т 1 до температуры Т 2 изменение энтропии равно:
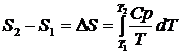 . (1.22)
. (1.22)
Зависимость Ср от температуры выражается уравнением
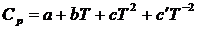 ,
,
Тогда
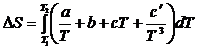 .
.
После интегрирования получим:
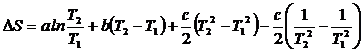 .
.
При V = const:
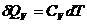 ,
,
Тогда
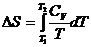 .
.
Изменение энтропии в ходе химической реакции, протекающей при
Т = const.
Так как энтропия – функция состояния, то ее изменение в ходе химической реакции можно рассчитать по уравнению:
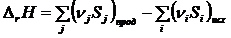 , (1.23)
, (1.23)
где Sj, Si – энтропии продуктов реакции и исходных веществ соответственно при температуре реакции; nj, ni – стехиометрические коэффициенты.
Если реакция протекает при температуре, отличной от 298 К, то энтропию вещества рассчитывают по уравнению (1.22), приняв для удобства за Т 1 температуру 298, а за Т 2 – температуру реакции:
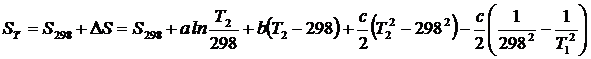 ,
,
где D S – изменение энтропии вещества при изменении температуры от 298 К до Т.
Тогда с учетом уравнения (1.23) получим:
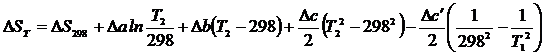 ,
,
где 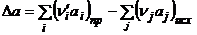 и т.д.
и т.д.
Абсолютные значения энтропии твердых, жидких
И газообразных тел
 2018-03-09
2018-03-09 110
110








