Химический изомерный сдвиг (d) есть разность между энергиями ядерных переходов источника и поглотителя. Он возникает вследствие различного радиуса ядра в основном и возбужденном состоянии и различного кулоновского взаимодействия заряда ядер источника и поглотителя, находящихся в различном химическом окружении (рис.4). Математически химический сдвиг выражается как [3]:
d = 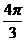 Ze2R2
Ze2R2  {çYа(0)- Ys(0)ç2}
{çYа(0)- Ys(0)ç2}  (5)
(5)
Это выражение состоит из двух множителей. Первый содержит только ядерные параметры – разность радиусов ядер основного и возбужденного состояния DR; второй çYа(0)-Ys(0)ç2 является атомным параметром и представляет собой разность плотностей заряда на ядре поглотителя и излучателя. Экспериментально химический сдвиг определяется по смещению центра тяжести резонансного спектра от нулевой скорости движения источника (рис. 5).
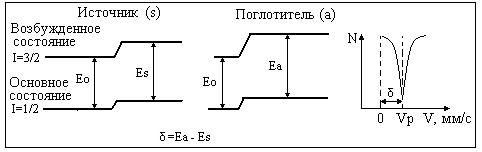
Рис. 5. Иллюстрация возникновения химического изомерного сдвига: Ео – энергия ядерного перехода в источнике и поглотителе без учета различия радиусов ядер основного и возбужденного состояния; Es - энергия ядерного перехода в источнике c учетом различия радиусов ядер и электростатического взаимодействия заряда ядра и электронной оболочки; Ea - энергия ядерного перехода в поглотителе c учетом различия радиусов ядер и электростатического взаимодействия заряда ядра и электронной оболочки.
Эта иллюстрация изомерного химического сдвига для предположения, что ядро является сферическим и его спин равен 0 или 1/2. В этом случае отсутствует расщепление ядерных уровней и мёссбауэровский спектр представляет собой одиночную линию (синглет). Поскольку химический сдвиг (d) зависит от электронной плотности на ядре, он является чувствительной характеристикой валентного состояния ионов железа и олова. Интерпретация химических сдвигов в различных минералах была впервые проведена Р.Уолкером с соавторами. [9]. Электронные конфигурации ионов Fe2+ -3 d6 и Fe3+ 3d5 отличаются друг от друга одним d - электроном, который не вносит существенного вклада в электронную плотность на ядре. Авторы показали, что добавление одного 3d -электрона увеличивает экранировку 3 s -электронов, что уменьшает их плотность на ядре и приводит к значительному увеличению химического сдвига для Fe2+ .
Исследованиями различных минералов установлено, что химический сдвиг Fe3+ и Fe2+ высокоспиновых соединений различен [10]. Он зависит не только от степени экранирования s -электронов d -электронами, но и от плотности 4 s -электронов, влияющих на степень ионности-ковалентности химической связи ионов железа. Накопленные экспериментальные исследования позволили сделать вывод о том, что в большинстве случаев с увеличением ковалентности связи химический сдвиг уменьшается [3]. Этим объясняются зависимость химического сдвига от координации ионов железа. Низкоспиновые комплексы характеризуются близкими значениями d для Fe2+ и Fe3+ и составляют 0,31-0,8 мм/c.
Таким образом, систематизируя влияние вышеприведенных эффектов на величину химического сдвига на ядрах Fe57 можно сделать выводы, что при увеличении степени окисления железа происходит уменьшение химического сдвига (уменьшение заселенности 3 d -орбиталей катионов железа); с понижением координационного числа (n) в полиэдре Fe X n (при фиксированном значении формальной степени окисления железа) уменьшается значение химического сдвига. Данный эффект может быть связан с понижением длины связей Fe- X (при уменьшении координационного числа в полиэдре Fe X n) и, как следствие, увеличением степени их ковалентности; при увеличении электроотрицательности лиганда уменьшается доля переноса электронов в 4 s - и 3 d -орбитали катионов железа, что, приведет к увеличению химического сдвига (влияние на значение химического сдвига 4 s - электронов, как правило, оказывается более существенным, чем 3 d -электронов).
В отличие от соединений железа, увеличение электронной плотности |Ψs(0)|2п на ядрах атомов Sn119 всегда приводит к увеличению соответствующего им химического сдвига. Поскольку для атома олова валентными являются 5 s - и 5 p -орбитали изменение химического сдвига должно определяться заселенностью именно этих орбиталей.
Учитывая особенности химии олова, для которого характерно существование в основном только в трех различных валентных состояниях (0, +2, +4), экспериментальное установление степени окисления этого атома методом мёссбауэровской спектроскопии еще проще, чем в случае железа. На рисунке 6 приведены области значений химических сдвигов для олова. Из рисунка видно, что нет областей пересечения значений химических сдвигов, что облегчает экспериментаторам задачу по определению степеней окисления олова.

Рис. 6. Интервалы значений химических сдвигов для различных валентных состояний олова с различным анионным окружением
На значение химического сдвига на ядрах Sn119 так же, как и в случае атомов железа, оказывают влияние эффекты ковалентности. В этом случае их проявление сводится лишь к изменению степени заселенности 5 s - и 5 p -орбиталей. При этом наибольшее влияние на химический сдвиг оказывает непосредственно заселенность 5 s -орбиталей, роль же 5 p -электронов сводится только к понижающему химический сдвиг экранирующему эффекту, который не является в этом случае значительным.
Таким образом, при увеличении степени окисления олова происходит увеличение химического сдвига (данный эффект связан в основном с уменьшением заселенности 5 s -орбиталей), а при увеличении электроотрицательности лиганда уменьшается доля переноса электронов в 5 s -орбиталь катионов олова, что приведет к уменьшению химического сдвига.
Температурный сдвиг линий возникают за счет изменения колебательной энергии кристалла при изменении его температуры. При испускании ядром g-кванта с энергией Е его масса уменьшается на величину dМ = -Е/с2. В безотдаточном процессе импульс Р не меняется, следовательно его кинетическая энергия при этом должна увеличиться. Эта энергия передается твердому телу, вследствие чего энергия g-кванта уменьшается на такую же величину, что в свою очередь приводит к изменению колебательных движений кристалла. Ничтожно малое изменение колебательной энергии кристалла на величину dЕк можно легко обнаружить благодаря исключительной чувствительности метода g-резонанса. Впервые такой эффект наблюдали Паунд и Ребка [4]. Этот эффект называют температурным сдвигом линии. Математически сдвиг допплеровской скорости выражается как
DV = -  , (6)
, (6)
где k0 – постоянная Больцмана, Т – температура М –масса атома, с – скорость света, q - температура Дебая.
Отсюда видно, что температурный сдвиг линии меняется линейно с коэффициентом наклона 3k0/2Mc [4] и из температурного сдвига можно определить температуру Дебая, а затем теплоемкость для одноатомной решетки по формуле
С = 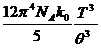 , (7)
, (7)
где NA – число Авогардо.
1.2.3. Квадрупольное расщепление (Δ).
Квадрупольное расщепление (D) возникает в результате взаимодействия квадрупольного момента ядра с градиентом электрического поля (ГЭП) на ядре, когда. происходит отклонение формы ядра от сферической симметрии. Сплющенное ядро имеет отрицательный, а вытянутое положительный квадрупольный момент. Квадрупольный момент ядра сферической формы со спином 0 или 1/2, равен 0. Неоднородное электрическое поле на ядрах создают собственные электроны атома и атомы лигандов. В результате взаимодействия квадрупольного момента ядра с градиентом электрического поля возбужденный уровень ядра со спином I=3/2 расщепляется на два подуровня и создается возможность реализации двух резонансных переходов. Мёссбауэровский спектр в этом случае представляет собой дублет (рис.7).
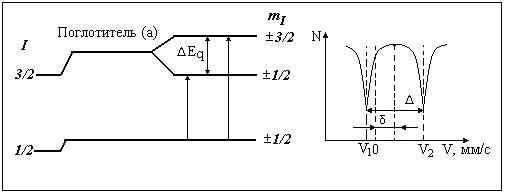
Рис.7. Иллюстрация возникновения квадрупольного расщепления.
Градиент электрического поля можно полностью определить тремя компонентами:
Vxx =  , Vyy =
, Vyy =  , Vzz =
, Vzz =  , (8)
, (8)
где V – потенциал электрического поля. Данные три компоненты подчиняются уравнению Лапласа Vxx +Vyy + Vzz = 0. В результате этого градиент электрического поля может быть определен двумя компонентами за которые выбирают Vzz, часто обозначаемую как eq, и параметр асимметрии h определяемый выражением
h = 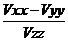 (9)
(9)
Компоненты градиента электрического поля обычно выбирают так, чтобы |Vzz| > |Vxx|>|Vyy|. В этом случае 0 £ h £ 1.
Если кристалл обладает осями третьего и четвертого порядка, то выбирается эту ось за ось z и тогда Vxx и Vуу равны, а h =0. В этом случае энергия взаимодействия квадрупольного момента ядра с градиентом электрического поля записывается как
Eq = 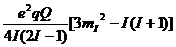 , (10)
, (10)
где mI -магнитное квантовое число. mI = I, I -1, …- I. Q – квадрупольный момент ядра. Если же h ≠ 0, то
Eq = 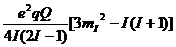 (1+
(1+ 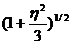 , (11)
, (11)
где, Q - квадрупольный момент ядра, q -градиент электрического поля (ГЭП), h - параметр асимметрии е - заряд электрона.
Экспериментально квадрупольное расщепление дублета можно определить по расстоянию на шкале скоростей между центрами тяжести двух резонансных линий мёссбауэровского спектра (рис. 6) как Δ = V2 – V1. а изомерный химический сдвиг при этом определяется как
δ =  (12)
(12)
Величины Eq и D пропорциональны, поэтому практически квадрупольное расщепление, как и изомерный химический сдвиг, принято выражать в мм/с.
В градиент электрического поля q вносят вклад как собственные электроны атома (валентный вклад), так и от окружающего заряженного комплекса (решеточный вклад). Эти вклады имеют противоположные знаки. В общем случае градиент, когда распределение заряда не является симметричным относительно оси z градиент электрического поля можно представить как
q = (1-R)qval +(1-g¥) qlat,, (13)
где qвал вклад в градиент поля, создаваемый собственной электронной оболочкой иона; qреш – вклад, создаваемый лигандами; R и g¥ - соответственно, константы антиэкранирования и экранирования Штернхеймера, характеризующие поляризацию электронной оболочки.
Квадрупольное расщепление для ионов Fe3+ обусловлено, в основном, лигандным полем, т.к. собственные электроны имеют сферическую симметрию. Оно мало и слабо зависит от температуры. В ионах Fe2+ градиент электрического поля вызван в значительной мере вкладом собственных электронов при условии, что аксиальное или более низкосимметричное кристаллическое поле снимает вырождение энергетических уровней кубической симметрии. Этот вклад в квадрупольное расщепление составляет 3,7 мм/с и имеет сильную температурную зависимость, так как связан с больцмановским изменением заселенности уровней собственных электронов [11]. Поскольку вклад в квадрупольное расщепление за счет лигандного поля противоположен по знаку, поэтому результирующая величина квадрупольного расщепления для ионов Fe2+ получается меньше.
 2018-03-09
2018-03-09 343
343








