Полученная таким образом полипептидная цепь остается биологически неактивной до тех пор, пока она не свернется с образованием присущей ей нативной конформации, которая определяется аминокислотной последовательностью. В какой-то момент – во время синтеза полипептидной цепи или после его завершения – белок самопроизвольно по законам термодинамики принимает свою нативную конформацию. Однако часто новообразованная полипептидная цепь не может принять окончательную биологически активную конформацию, пока она не подвергнется процессингу или ковалентной модификации. Изменения в ходе этих процессов получили названия посттрансляционной модификации. У разных белков процессинг протекает по-разному.
Процессы, которые могут протекать в результате ковалентной модификации:
а) модификация N-конца и С-конца. С помощью специфических ферментов с N-конца удаляются N-формилметионин у прокариот, метионин у эукариот и часто несколько следующих аминокислот;
б) удаление сигнальных последовательностей. Некоторые белки содержат на N-конце дополнительную полипептидную последовательность из 15-30 остатков, которая направляет этот белок к месту его назначения в клетке. Одни белки поступают в цитоплазму, другие направляются к различным клеточным органеллам, третьи секретируются из клетки (инсулин, глюкагон), четвертые встраиваются в ту или иную клеточную мембрану, где работают в качестве транспортных белков или ферментов мембраны. Важно, чтобы вновь синтезированный белок нашел путь к предназначенному для него месту в клетке. Белки, синтезируемые рибосомами шероховатого эндоплазматического ретикулума в клетках поджелудочной железы и экспортируемые из этих клеток (трипсиноген, прокарбоксипептидаза), имеют на N-конце лидирующие последовательности, содержащие в аминокислотных остатках гидрофобные R-группы. Такие лидеры узнаются особыми рецепторными участками на внешней поверхности эндоплазматического ретикулума, причем это происходит даже раньше, чем рибосома полностью завершит синтез белка. Гидрофобная растворимая часть этой последовательности проникает сквозь мембрану внутрь цистерн эндоплазматического ретикулума, протаскивая за собой растущую полипептидную цепь. Внутри цистерн под действием особой пептидазы отщепляется сигнальная последовательность. После этого зрелый белок направляется в аппарат Гольджи, инкапсулируется и в виде секреторного пузырька покидает клетку;
в) фосфорилирование гидроксиаминокислот. В ряде белков гидроксильные группы некоторых сериновых, треониновых, пирозиновых остатков подвергаются ферментативному фосфорилированию с участием АТФ (например, казеин молока);
г) карбоксилирование. К остаткам аспарагиновой и глутаминовой кислот в ряде белков могут присоединятся дополнительные карбоксильные группы. Например, белок системы свертывания крови протомбин содержит в своей N-концевой области несколько остатков γ-карбоксиглутаминовой кислоты, которые включаются в белок при помощи фермента, зависимого от витамина К. Карбоксильные группы связывают ионы Са2+, необходимые для запуска механизма свертывания крови;
д) метилирование групп. В ряде белков определенные остатки лизина подвергаются ферментативному метилированию. Остатки монометил- и диметиллизина обнаруживаются в некоторых мышечных белках и цитохроме С. В других белках метилированию подвергаются карбоксильные группы ряда остатков глутаминовой кислоты, что приводит к нейтрализации их отрицательных зарядов;
г) присоединение боковых углеводных цепей. Боковые углеводные цепи гликопротеинов ковалентно присоединяются к полипептиду во время или после синтеза последнего. В одних гликопротеинах боковая углеводная цепь прикрепляется с помощью ферментов к остаткам аспарагиновой кислоты, а других – серина или треонина. Многие белки, которые работают вне клетки, а также «смазочные» протеоглюканы, покрывающие слизистые оболочки, содержат боковые олигосахаридные цепи;
ж) добавление простетических групп. В состав многих ферментов входят обязательные для их активности ковалентно связанные с белком простетические группы. Примеров таких простетических групп много (биотин, ковалентно связанный с ацетил-КоА-карбоксилазой; гемовая группа цитохрома С);
з) образование дисульфидных мостиков. Во многих белках, предназначенных для выхода из клетки в процессе формирования их нативной конформации, появляются поперечные сшивки в результате ферментативного образования дисульфидных мостиков между остатками цистеина. Дисульфидные мостики могут быть между различными полипептидами или в одной полипептидной цепи (инсулин, химотрипсин и др.).
РЕГУЛЯЦИЯ БИОСИНТЕЗА
Живые клетки имеют точно запрограммированные механизмы, регулирующие синтез различных белков таким образом, что в любой клетке присутствует определенное количество молекул каждого белка. ДНК бактерии E.Coli содержит гены для более чем 3000 различных белков. Однако 3000 белков бактерии присутствуют в клетке не в одинаковых количествах. Некоторые белки существуют в незначительном количестве копий, тогда как количество других постоянно и достаточно велико. Благодаря регуляции синтеза ферментов в клетках любого типа создается «правильный» набор ферментов, обеспечивающих нормальное протекание основных клеточных процессов. Регуляция позволяет бактериям экономно использовать аминокислоты для синтеза тех белков, которые нужны им лишь в очень малых количествах или только изредка.
У высших организмов процессы регуляции белкового синтеза значительно сложнее. Хотя каждая клетка эукариот содержит полный геном данного организма, в клетках данного типа экспрессируется только часть структурных генов. Почти во всех клетках высших животных присутствуют наборы основных ферментов, необходимые для реализации главных путей метаболизма. Однако клетки разных типов, например, клетки мышц, мозга, печени, содержат свойственные только им структуры и выполняют только им присущие биологические функции, реализация которых обеспечивается наборами специализированных белков. Биосинтез разных наборов специализированных белков должен быть точно запрограммирован в последовательности и времени их появления в ходе строго упорядоченной дифференцировки и роста высших организмов. Пока не все известно о регуляции экспрессии генов в эукариотических организмах с их многочисленными хромосомами. Однако сегодня наука располагает значительной информацией о регуляции синтеза белка у прокариот.
Бактерии содержат конститутивные и индуцируемые ферменты. Конститутивные ферменты присутствуют в бактериальных клетках в постоянных количествах независимо от метаболического состояния организма (ферменты гликоза). Концентрация индуцируемых ферментов меняется, они синтезируются только по мере надобности, когда в среду добавляют его субстрат, особенно если этот субстрат является единственным источником углерода. Таким ферментом может быть β-галактозидаза, которая способствует расщеплению лактозы на глюкозу и галактозу. В обычных условиях, когда в среде есть глюкоза, бактерия E.Coli лактозу не усваивает, так как фермента β-галактозидазы очень мало (~ 5 молекул). Однако если поместить E.Coli в среду с лактозой в качестве единственного источника углерода и энергии, то через 1-2 мин клетки начинают синтезировать фермент β-галактозидазу в больших количествах (~1000 молекул на одну клетку). Если в среду добавить глюкозу, синтез фермента β-галактозидазы прекращается. Таким образом, индуцируемые ферменты синтезируются только тогда, когда в них есть необходимость. Индукция – очень экономичный процесс. Вещество, способное индуцировать синтез ферментов или группы ферментов, называют индуктором (лактоза в данном случае). При добавлении лактозы в среду не содержащую глюкозы, бактерия кроме β-галактозидазы начинает синтезировать два родственных белка: β-галактозидпермиазу, необходимую для прохождению лактозы через клеточную мембрану, и β-галактозидтрансацетилазу, катализирующую перенос ацетильного остатка от ацетилКоА на галактозу. Значение этого фермента при использовании клетками лактозы неизвестно. Если один индуктор (лактоза) вызывает синтез группы связанных между собой ферментов, то такой процесс называется координированной индукцией.
Другой важный тип изменения концентрации ферментов в бактериальной клетке, противоположной по своему проявлению индукции ферментов, – репрессия ферментов. Когда клетки бактерии E.Coli растут в среде, содержащей в качестве единственного источника азота соль аммония, им приходится синтезировать все азотсодержащие соединения из иона NH4+ и углерода. Такие клетки должны иметь все ферменты для синтеза 20 аминокислот. Если же в среду добавить одну какую-нибудь аминокислоту (гистидин), то клетка перестает вырабатывать весь набор ферментов, необходимых для синтеза гистидина из NH4+, а для остальных 19 аминокислот синтез ферментов продолжается. Выключение синтеза ферментов, ответственных за образование гистидина, вызванное добавлением гистидина, называется репрессией ферментов.
Молекулярные и генетические связи между индукцией и репрессией ферментов прояснились в результате генетических исследований Франсуа Жакоба и Жака Моно. Их классическая работа по индукции β-галактозидазной активности привела к формулировке гипотезы оперона для объяснения генной регуляции. Гипотеза получила полное подтверждение. Регуляция биосинтеза у бактерий происходит на уровне транскрипции, т. е. на стадии синтеза мРНК.

Жакоб и Моно предположили, что три структурных гена - z, y, a - на ДНК, кодирующие синтез индуцируемых лактозой ферментов, расположены рядом в хромосоме E.Coli. В ДНК около этих генов находится ингибиторный участок (регуляторный ген - i-ген), который способен ингибировать транскрипцию трех структурных генов - z, y, a. Регуляторный ген кодирует аминокислотную последовательность белка-репрессора. Когда i-ген транскрибируется с образованием мРНК, на последней рибосоме синтезируется белок-репрессор. Белок-репрессор способен связываться с участком ДНК, называемым оператором, который расположен рядом со структурными генами. Было высказано предположение, что связывание репрессора с операторным участком ДНК подавляет катализируемый РНК-полимеразой процесс транскрипции трех структурных генов. Вследствие отсутствия матрицы синтеза белков-ферментов не происходит (т. е. репрессируется). Далее Жакоб и Моно предположили, что индуктор (лактоза) связывается со вторым специфическим участком белка-репрессора, при этом образуется индуктор-репрессорный комплекс, что приводит к снижению сродства репрессора к операторному участку ДНК и освобождению последнего. Структурные гены оказываются доступными для транскрипции, и РНК-полимераза синтезирует с них мРНК. мРНК используется для синтеза белков-ферментов в рибосомах, в результате чего клетка получает возможность утилизировать лактозу в качестве источника углерода и энергии. Как только лактоза исчезает, индукторно-репрессорный центр распадается, белок-репрессор возвращается в свое активное состояние и присоединяется к оператору. Структурные гены перестают транскрибироваться, синтез белков прекращается. Три структурных гена с их оператором были названы опероном. В данном случае lac-опероном (рис.17).
В настоящее время гипотеза Жакоба и Моно полностью подтверждена. Известно большое число регулируемых оперонов. Lac-оперон изучен лучше всего. Lac-репрессор – тетрамерный белок. Это четыре идентичных субъединицы с массой 37 кДа, каждая из которых имеет один участок связывания с индуктором, имеется участок связывания с оператором. Связывание репрессора с оператором очень прочное. Одним из наиболее сложных оперонов является гистидиновый оперон. Он состоит из девяти структурных генов, кодирующих набор ферментов, необходимых для биосинтеза гистидина в бактериальной клетке. Регуляторный ген his-оперона кодирует белок-репрессор, который присоединяется к his-оператору и тем самым препятствует транскрипции всех девяти белков оперона в условиях, когда в среде присутствует достаточное количество гистидина.
Итак, если в среде присутствует лактоза и нет глюкозы, то индуктор, соединяясь с репрессором, «снимает» его с оператора и тем самым дает возможность транскрибироваться lас-генам и соответственно синтезироваться lac-белкам.
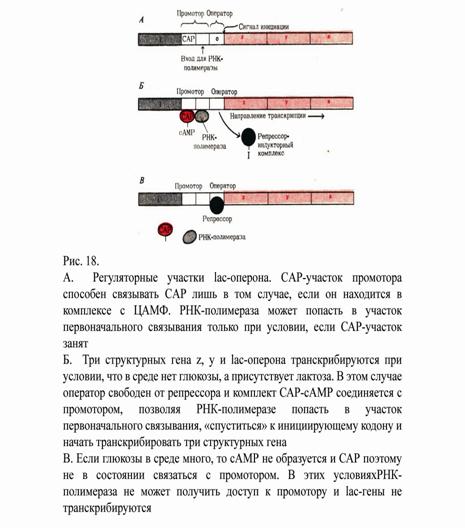
Предположим теперь, что в среде есть лактоза и есть глюкоза. В этих условиях E.Coli использует только глюкозу, пренебрегая лактозой. Клетки перестают синтезировать lac-белки. Репрессия синтеза lac-белков глюкозой называется катаболитной репрессией (рис.18). В дополнение к i-гену и оператору (о-участок) в ДНК существует еще один регуляторный участок – промотор (р-участок, между геном i и оператором). Промотор состоит из двух функционально различных частей. Рядом с оператором находится «вход для РНК-полимеразы», т. е. участок, в котором происходит первоначальное связывание РНК-полимеразы. Второй участок промотора – специфический участок связывания другого регуляторного белка – белка активирующего катабалитный ген (БАК, САР-анг). Эта часть держит под контролем «вход для РНК-полимеразы». Если в среде нет глюкозы, то в клетке формируется комплекс между БАК и цАМФ. Этот комплекс соединяется с БАК-участком (САР-участок) ДНК и дает возможность РНК-полимеразе попасть на участок первоначального связывания. Если в среде есть лактоза, то о-участок свободен, РНК-полимераза перемещается от своего первоначального места через область оператора и начинает транскрибировать три lac-гена. Короче говоря, БАК-участок обеспечивает доступность участка первоначального связывания РНК-полимеразы, только будучи соединенным с комплексом БАК-ц-АМФ.
Если же в среде присутствует глюкоза, то концентрация ц-АМФ [ц-АМФ] сильно снижается и комплекс БАК с цАМФ не образуется и БАК участок ДНК не может обеспечить доступность участка первоначального связывания РНК-полимеразе: она не присоединяется на промоторный участок и lac-гены не транскрибируются.
У бактерии E.Coli цАМФ служит посредником: он сигнализирует о том, есть ли в ростовой среде глюкоза. Клетки E.Coli содержат фермент аденилатциклазу, который катализирует образование ц-АМФ из АТФ; в этих клетках имеется также фосфодиэстераза, которая гидролизует ц-АМФ и тем самым инактивирует его. Увеличение или уменьшение активности этих ферментов связано каким-то образом с концентрацией глюкозы в среде. Таким образом, повышение [ц-АМФ] – это «сигнал голода». Последующие биохимические и генетические исследования показали, что циклический АМФ стимулирует инициирование транскрипции многих индуцибельных оперонов. В БАК-белке имеется как в репрессоре два центра: первый – для связывания с БАК-участком промотора и второй для связываниф ц-АМФ. БАК-белок представляет собой димер из субъединиц массой 22кДа.
Большая часть lac-оперона E.Coli уже определена. Известна полная нуклеотидная последовательность оператора и промотора. Весь промотор состоит из 85 нуклеотидных пар, причем на долю БАК-участка приходится 38, а на долю участка первоначального связывания РНК-полимеразы – около 40 пар оснований.
Кроме оперонов с их регуляторными генами бактерии обладают и другими механизмами регуляции биосинтеза. В некоторых случаях регуляция осуществляется за счет постепенного снижения скорости синтеза белка (аттенуация). Например, транскрипция триптофан-оперона регулируется участком контролируемой терминации, называемым аттенюатором. Он локализован между оператором и геном первого фермента пути биосинтеза триптофана. Из всего сказанного ясно, что бактерии обладают тончайшими механизмами регуляции синтеза своих ферментов, позволяющими им оптимизировать свой метаболизм в соответствии с принципом максимальной экономии.
 2018-03-09
2018-03-09 677
677








