Все виды взаимодействий между атомами независимо от их физической природы при формировании различных макромолекулярных связей можно разделить на 2 основных типа:
1. взаимодействия ближнего порядка между атомами соседних звеньев;
2. дальние взаимодействия между атомами, которые хотя и отстоят по цепи далеко друг от друга, но случайно встретились в пространстве в результате изгибов цепи.
В качестве простейшей модели биополимера рассмотрим свободно-сочлененную цепь. Будем считать, что цепь состоит из ряда прямолинейных сегментов, каждый из которых включает определенное число отдельных звеньев. Внутри каждого сегмента сохраняется абсолютная корреляция в ориентации звеньев. При этом между сегментами эта корреляция полностью отсутствует.
 Радиус-вектор
Радиус-вектор 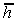 между концами цепи может быть представлен в виде суммы отдельных векторов li, характеризующих каждый сегмент.
между концами цепи может быть представлен в виде суммы отдельных векторов li, характеризующих каждый сегмент.
Каждое макросостояние полимера характеризуется определенными значениями молекулярных параметров и может осуществляться большим количеством микросостояний (конформаций). Тепловое движение и вращение вокруг одинарных связей (пептидных) должно приводить к значительной свернутости цепи и образованию клубка.
Сворачиваемость цепи в клубок определяется термодинамической гибкостью: чем больше гибкость, тем меньше h 2. При растяжении полимеров происходит развертывание клубка и уменьшение размера возможных конформаций, что сопровождается уменьшением энтропии.
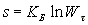 ,где w - термодинамическая вероятност, kБ - константа Больцмана.
,где w - термодинамическая вероятност, kБ - константа Больцмана.
Геометрические размеры задаются с помощью среднеквадратичного расстояния биополимера - h2. Внутренняя пространственная структура задаётся пространственным распределением плотности звеньев. Вследствие объёмного взаимодействия, число звеньев в пространстве может меняться от точки к точке.
В полимерных нитях, вследствие взаимосвязанности звеньев, изменение плотности в одной точке пространства связано с изменением плотности в другой точке, то есть существует пространственная корреляция плотности. Если в макромолекуле отсутствует объёмное взаимодействие, то она не имеет достоверной пространственной структуры. В этом состоянии флуктуация (изменение вероятности) плотности имеет значение того же порядка, что и сама плотность. Такое состояние носит название клубка.
Наличие объёмных взаимодействий может привести к такому состоянию, в котором флуктуация плотности мала по сравнению с самой плотностью. Такое плотное образование называется глобулой. В нем радиус корреляции флуктуации плотности намного меньше размеров молекулы 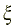 <<R. Глобула в отличие от клубка обладает компактной пространственной структурой. Сердцевина большой глобулы примерно однородна, с постоянной концентрацией звеньев n0.
<<R. Глобула в отличие от клубка обладает компактной пространственной структурой. Сердцевина большой глобулы примерно однородна, с постоянной концентрацией звеньев n0.
16. Физика белка. Функции белков.
Белки — непременные участники всех процессов жизнедеятельности. Белки- ферменты катализируют все химические, электрохимические и механохимические процессы в клетках и в организмах. Важнейшей функцией белков можно считать ферментативную. Специализированные ферменты служат катализаторами всех метаболических реакций, репликации ДНК, транскрипции текста ДНК в текст мРНК, трансляции этого текста при биосинтезе белка. Белки являются и регуляторами генетических функций нуклеиновых кислот. Регуляторные ферменты, называемые аллостерическими (гл. 6), обеспечивают обратные связи в метаболических цепях.
Движение клеток и организмов, выполнение ими механической работы например, мышечной) производятся особыми сократительными белками, служащими рабочими веществами этих процессов. Сократительные белки выполняют ферментативную, АТФ-азную функцию, реализуют превращение химической энергии (запасенной в АТФ, с. 40) в механическую работу. Белки определяют все метаболические и биоэнергетические процессы.
В организмах животных некоторые специальные белки выполняют особые функции. Белки служат для запасания (миоглобин) и переноса (гемоглобин, гемоцианин) кислорода. Некоторые низкомолекулярные белки, точнее, полипептиды, являются гормонами (с. 50). Гамма-глобулины высших организмов защищают их от чужеродных биополимеров, функционируя в качестве антител — в иммунных процессах. Наконец, белки, входящие в состав соединительной ткани, хрящей и сухожилий, а также белки кожи, волос и перьев выполняют опорную функцию, обеспечивая надежную и в то же время подвижную взаимосвязь органов, целостность организма и его защиту от внещних воздействий.
Можно сказать, что белки являются обязательными участниками запасания, передачи, трансформации и рецепции химических сигналов — макромолекул, молекул и ионов — в живых системах. Во многих случаях сигналами, их рецепторами и преобразователями служат сами белки. Белки, входящие в состав, рецепторных систем организма, перекодируют внешние сигналы на химический и электрохимический язык.
Молекулы белков — самые сложные из известных науке. Их биологически функциональная пространственная структура, а также структура надмолекулярных систем, содержащих белки (мембраны и др.), определяются как химическими связями в белковых цепях, так и целой гаммой слабых взаимодействий. Нативные белки никогда не являются статистическими клубками. Белковые глобулы — апериодические кристаллы сложной структуры. Это нестатистические, но динамические системы, своего рода машины, поведение которых зависит от положения и свойств всех их элементов. Наряду с глобулярными существуют фибриллярные белки — сократительные и опорные.
Денатурация белка, т. е. утрата им биологической функциональности при нагревании, воздействии кислот, оснований и других веществ, состоит в разрушении слабых взаимодействий и в конечном счете в превращении конденсированного тела (глобулы или фибриллы) в статистический клубок.
 2018-02-13
2018-02-13 2497
2497
