Источники
Хорошими источниками витамина К являются капуста, крапива, рябина, шпинат, тыква, арахисовое масло, печень (филлохинон). Также витамин образуется микрофлорой в тонком кишечнике (менахинон). Запасы витамина в печени составляют около 30 суточных доз.
Суточная потребность
Около 2 мг.
Строение
Витамины содержат функциональное нафтохиноновое кольцо и алифатическую изопреноидную боковую цепь.
Выделяют три формы витамина: витамин К1 (филлохинон), витамин К2 (менахинон), витамин К3 (менадион). После всасывания менадион превращается в активную форму – менахинон.
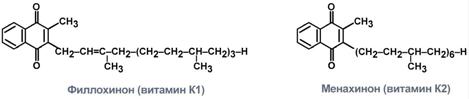
Строение двух форм витамина К
Биохимические функции
К настоящему времени у человека обнаружено 14 витамин К-зависимых белков, играющих ключевые роли в регулировании физиологических процессов. Например, витамин является коферментом микросомальных ферментов печени, осуществляющих γ-карбоксилирование (γ – "гамма", греч) глутаминовой кислоты в составе белковой цепи (полная реакция).
Участие витамина К в реакциях γ-карбоксилирования белков
Благодаря своей функции витамин обеспечивает:
1. Синтез факторов свертывания крови в печени – Кристмаса (ф.IX), Стюарта (ф.X), проконвертина (ф.VII), протромбина (ф.II);
2. Синтез белков костной ткани, например, остеокальцина.
3. Синтез протеина C и протеина S, участвующих в работе антисвертывающей системы крови.
Гиповитаминоз
Причина
Возникает при подавлении микрофлоры лекарствами, особенно антибиотиками, при заболеваниях печени и желчного пузыря. У взрослых здоровая кишечная микрофлора полностью удовлетворяет потребность организма в витамине.
Клиническая картина
Наблюдается кровоточивость, снижение свертываемости крови, легкое возникновение подкожных гематом, у женщин отмечаются обильные mensis.
9. Ферменты или энзимы (Е) - это специфические белки, содержащиеся во всех клетках организма человека и являющиеся биологическими катализаторами.
Ферменты являются посредниками между организмом и окружающей средой, обеспечивают адаптацию организма к изменяющимся условиям (авторегуляторы).
В онтогенезе отмечается разнообразие возрастных изменений индукции ферментов. Разные периоды индукции определяют необходимость синтеза тех или иных ферментов. Важнейшим фактором, меняющим метаболизм детского организма, служит изменение условий питания, в частности, характер вводимой пищи. Это положение относится не только к гидролитическим ферментам желудочно-кишечного тракта. От количества и состава пищи зависит активность и тканевых энзимов. Например, на рационе, содержащем много белка в пище, наблюдается увеличение активности ферментов, синтезирующих мочевину и превращение аминокислот.
Классификация ферментов:
Основой классификации ферментов служит тип катализируемой реакции. Согласно данной классификации ферменты делят на шесть классов:
1. Оксидоредуктазы ( катализируют окислительно-восстановительные реакции).
2. Трансферазы (катализируют реакции межмолекулярного переноса атомов, групп атомов, радикалов).
3. Гидролазы (катализируют расщепление внутримолекулярных связей органических молекул с участием воды).
4. Изомеразы (катализируют взаимопревращения оптических и геометрических изомеров).
5. Лиазы (катализируют разрыв связей С-О, С-С, С-N, а также обратимые реакции отщепления различных групп от субстратов негидролитическим путем).
6. Лигазы (катализируют синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ).
Классы состоят из подклассов, подклассы из подподклассов.
.Значение ферментов в диагностике и прогнозе заболеваний. Ферменты – лечебные препараты. Энзимопатии.
Для каждой ткани (органа) характерен определённый ферментный состав (маркерные ферменты). Для сердечной мышцы маркерными ферментами являются - аспартатаминотрансфераза (АсТ), креатинкиназа; для печени – аланинаминотрансфераза (АлТ); для предстательной железы – кислая фосфатаза (КФ); для поджелудочной железы – α-амилаза и т.д.
При заболеваниях, сопровождающихся некрозом, маркерные (органоспецифичные) ферменты из повреждённых клеток в большом количестве поступают в кровь, и уровень их активности увеличивается, возникает гиперферментемия. Определение уровня активности маркерных ферментов в сыворотке крови имеет клиническое значение в диагностике и прогнозе ряда заболеваний.
Так, при инфаркте миокарда увеличивается уровень активности АсТ, креатиназы; вирусном гепатите – АлТ; раке предстательной железы – кислой фосфатазы; при заболеваниях поджелудочной железы – α-амилазы и т.д.
Некоторые ферменты применяют в качестве лечебных препаратов:
· Пепсин – при нарушении синтеза и секреции пепсина в желудке;
· Трипсин, химотрипсин используются для лечения гнойных ран;
· Фибринолизин, стрептокиназа – для предотвращения тромбообразования при пересадке органов и других операциях;
· Гиалуронидаза обеспечивает рассасывание рубцов;
· Аспарагиназа применяется при лечении некоторых злокачественных образований и т.д.
При отсутствии или недостатке тех или иных ферментов, связанных с мутацией гена, ответственного за синтез белка – фермента, возникают наследственные энзимопатии.
 2018-02-13
2018-02-13 531
531








