- Закон Столетова: при неизменном спектральном составе электромагнитных излучений, падающих на фотокатод, фототок насыщения пропорционален энергетической освещенности катода (иначе: число фотоэлектронов, выбиваемых из катода за 1 с, прямо пропорционально интенсивности излучения):
 и
и 
- Максимальная начальная скорость фотоэлектронов не зависит от интенсивности падающего света, а определяется только его частотой.
- Для каждого вещества существует красная граница фотоэффекта, то есть минимальная частота ν0 света (зависящая от химической природы вещества и состояния поверхности), ниже которой фотоэффект невозможен.
19. Фото́н (от др.-греч. φῶς, род. пад. φωτός, «свет») — элементарная частица, квант электромагнитного излучения. Это безмассовая частица, способная существовать только двигаясь со скоростью света. Электрический заряд фотона равен нулю. Фотон — это элементарная частица, обладающая энергией 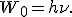
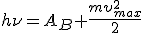 — уравнение Эйнштейна для фотоэффекта.
— уравнение Эйнштейна для фотоэффекта.
Оно представляет собой закон сохранения энергии в применении к фотоэффекту. Это уравнение записано для однофотонного фотоэффекта, когда речь идет о вырывании электрона, не связанного с атомом (молекулой).
20. Энергия фотона
e =hv=  ,
,
где h=6.6*10-34 Дж*с - постоянная Планка, 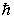 = h/2p=1.055*10-34 Дж*с также постоянная Планка, w=2pv - круговая частота.
= h/2p=1.055*10-34 Дж*с также постоянная Планка, w=2pv - круговая частота.
Масса фотона определяется исходя из закона о взаимосвязи массы и энергии (Е=mc2)
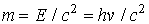
Импульс фотона. Для любой релятивиской частицы энергия ее  Поскольку у фотона m0=0, то импульс фотона
Поскольку у фотона m0=0, то импульс фотона

т.е. длина волны обратно пропорциональна импульсу.
Давление и преломление света объясняются как волновой, так и квантовой теориями. Таким образом, электромагнитное излучение обнаруживает удивительное единство, казалось бы, взаимоисключающих свойств — непрерывных (волны) и дискретных (фотоны), которые взаимно дополняют друг друга.
Основные уравнения (см. §205), связывающие корпускулярные свойства электромагнитного излучения (энергия и импульс фотона) с волновыми свойствами (частота или длина волны):
eg=hn, pg=hn/c=h/l.
21. А́том (от др.-греч. ἄτομος — неделимый) — наименьшая химически неделимая часть химического элемента, являющаяся носителем его свойств. Атом состоит из атомного ядра и электронов. Ядро атома состоит из положительно заряженных протонов и незаряженных нейтронов. Если число протонов в ядре совпадает с числом электронов, то атом в целом оказывается электрически нейтральным. В противном случае он обладает некоторым положительным или отрицательным зарядом и называется ионом. Атомы классифицируются по количеству протонов и нейтронов в ядре: количество протонов определяет принадлежность атома некоторому химическому элементу, а число нейтронов — изотопу этого элемента.
Атомы различного вида в разных количествах, связанные межатомными связями, образуют молекулы.
Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно, и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка[1]:  .
.
Используя это допущение и законы классической механики, а именно равенство силы притяжения электрона со стороны ядра и центробежной силы, действующей на вращающийся электрон, он получил следующие значения для радиуса стационарной орбиты Rn и энергии En находящегося на этой орбите электрона:
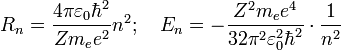
Здесь me — масса электрона, Z — количество протонов в ядре, ε0 — диэлектрическая постоянная, e — заряд электрона.
22. Дифракция частиц, рассеяние микрочастиц (электронов, нейтронов, атомов и т.п.) кристаллами или молекулами жидкостей и газов, при котором из начального пучка частиц данного типа возникают дополнительно отклонённые пучки этих частиц; направление и интенсивность таких отклонённых пучков зависят от строения рассеивающего объекта.
Дифракция частиц может быть понята лишь на основе квантовой теории. Дифракция — явление волновое, оно наблюдается при распространении волн различной природы: дифракция света, звуковых волн, волн на поверхности жидкости и т.д. Дифракция при рассеянии частиц, с точки зрения классической физики, невозможна.
Формула де Бройля устанавливает зависимость длины волны λ, связанной с движущейся частицей вещества, от импульса p частицы:

где m — масса частицы, v — ее скорость, h — постоянная Планка. Волны, о которых идет речь, называются волнами де Бройля.
Другой вид формулы де Бройля:

где  — волновой вектор, модуль которого
— волновой вектор, модуль которого  — волновое число — есть число длин волн, укладывающихся на 2π единицах длины,
— волновое число — есть число длин волн, укладывающихся на 2π единицах длины,  — единичный вектор в направлении распространения волны,
— единичный вектор в направлении распространения волны, 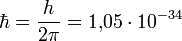 Дж·с.
Дж·с.
Корпускуля́рно-волново́й дуали́зм — принцип, согласно которому любой объект может проявлять как волновые, так и корпускулярные свойства. Был введён при разработке квантовой механики для интерпретации явлений, наблюдаемых в микромире, с точки зрения классических концепций. Дальнейшим развитием принципа корпускулярно-волнового дуализма стала концепция квантованных полей в квантовой теории поля.
Как классический пример, свет можно трактовать как поток корпускул (фотонов), которые во многих физических эффектах проявляют свойства электромагнитных волн. Свет демонстрирует свойства волны в явлениях дифракции и интерференции при масштабах, сравнимых с длиной световой волны. Например, даже одиночные фотоны, проходящие через двойную щель, создают на экране интерференционную картину, определяемую уравнениями Максвелла.
23. волновые характеристики микрообъектов связаны такими же количественными соотношениями, как и у фотона:

24. Функцию Yназывают волновой функций или пси-функцией. Она, как правило, бывает комплексной.
Интепретацию волновой функции дал в 1926 г. Борн: квадрат модуля волновой функции определяет вероятность того, что частица будет обнаружена в пределах объема dV:
dP =|Y| 2 dV=YY*dV (17)
где Y * - комплексно - сопряженная волновая функция.
Величина |Y| 2=YY* = dP/ dV - имеет смысл плотности вероятности.
 2018-02-14
2018-02-14 256
256







