 , (11)
, (11)
где R ¢=1,10×107 м–1 – постоянная Ридберга. Так как 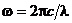 , то формулу (11) можно записать в виде
, то формулу (11) можно записать в виде
 , (12)
, (12)
где R =2p cR ¢=2,07×1016 рад/с – называется также постоянной Ридберга.
Спектральные линии, отличающиеся значениями n, образуют группу линий, называемой серией Бальмера. С увеличением n линии серии сближаются; значение n =¥ определяют границу серии, к которой со стороны больших частот примыкает сплошной спектр. В дальнейшем в спектре атома водорода было обнаружено еще несколько серий. В ультрафиолетовой области спектра находится серия Лаймана
 .
.
В инфракрасной области были также обнаружены серия Пашена
 ,
,
серия Брэкета и др. Все приведенные выше серии в спектре водорода могут быть описаны одной формулой, называемой обобщенной формулой Бальмера
 , (13)
, (13)
где  определяет серию,
определяет серию,  определяет отдельные линии серии.
определяет отдельные линии серии.
Функциональный вид сериальных формул, которые сводятся к одной обобщенной формуле (13), свидетельствует о наличии закономерности, объяснить которую в рамках классической физики оказалось невозможным.
Постулаты Бора. Опыты Франка и Герца. Первая попытка создать новую – квантовую – теорию ядра была осуществлена Н. Бором. Он поставил цель связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома Резерфорда и квантовый характер излучения и поглощения света. В основу новой теории Бор положил два постулата.
Первый постулат Бора (постулат стационарных состояний). В атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Стационарным состояниям атома соответствуют стационарные круговые орбиты, по которым движутся электроны. Движение электронов по стационарным орбитам не сопровождается излучением электромагнитных волн.
 2018-02-14
2018-02-14 605
605








