4.1. Расчет констант равновесия окислительно-восстановительных реакций.
Пример1. Вычислите константу равновесия окислительно-восстановительной реакции MnO4-+SO32-+H+=Mn2+ +SO42-+H2O
и сделать вывод о ее направлении.
Решение. Запишем уравнения полуреакций:
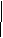 MnO4-+8H++5e=Mn2++4H2O 2
MnO4-+8H++5e=Mn2++4H2O 2
SO32-+H2O-2e=SO42-+2H+ 5
Запишем суммарное уравнение:
2MnO4-+5SO32-+16H+=2Mn2++5SO42-+8H2O
Находим по таблице стандартные окислительно-восстановительные потенциалы:
E0MnO4/Mn2+ =+1,51B, E0SO42-/SO32- =+0,17B. Число электронов, учавствующих в реакции, n=2·5=10.
Рассчитаем константу равновесия:
lgK=∆E0·n/0,059=(1,51-0,17)·10/0,059=231,0; K=10231>>1.
Следовательно, реакция будет протекать в прямом направлении.
Расчет окислительно-восстановительного потенциала.
Пример 2. Вычислить окислительно-восстановительный потенциал, если к 15,0мл 0,20М раствора KMnO4 добавили 50,0мл 0,10М раствора NaSO3 при рН=1.
Решение. При смешении растворов протекает реакция. Потенциал раствора после смешения будет определяться веществом, которое находится в избытке. Рассчитаем количество вещества (моль-экв) в обоих растворах:
n(1/5KMnO4)=15,0·10-3·0,02·5=15,0·10-3моль-экв;
n(1/2Na2SO4)=50,0·10-3·0,10·2=10,0·10-3моль-экв.
В избытке находится KMnO4. После протекания реакции в растворе будет содержаться
n(1/5MnO4-)=15,0·10-3-10,0·10-3=5,0·10-3моль-экв, следовательно
n(MnO4-)=1,0·10-3моль;
n(1/5Mn2+)=10,0·10-3моль-экв, следовательно
n(Mn2+)=2,0·10-3 моль.
Объем раствора после смешения составит 15,0+50,0=65,0мл=65·10-3л.
Рассчитаем концентрации ионов:
С(MnO4-)=1,0·10-3/65·10-3=0,0154 моль/л;
С(Mn2+)=2,0·10-3/65·10-3=0,0308 моль/л;
С(Н+)=10-рН=10-1=0,1 моль/л.
Рассчитаем окислительно-восстановительный потенциал раствора:
Е= E0MnO4/Mn2++0,059/5·([ MnO4- ]·[H+]8/[Mn2+])= 1,51+0,059/5·lg(0,0154·(0,1)8/0,0308)=1,49B.
Пример 3. Вычислить окислительно-восстановительный потенциал пары Hg22+/Hg в присутствии ионов Cl-, приняв концентрацию ионов Cl- равной 0,1 моль/л.
Решение. В присутствии ионов Cl- в растворе образуется малорастворимое соединение Hg2Cl2. Полуреакцию Hg2Cl2+2e=2Hg+2Cl- можно представить как сочетание реакций окисления-восстановления и осаждения:
2Hg22++2e=2Hg
Hg22++2Cl- =Hg2Cl2
Найдем по справочнику Е0Hg 22+/2Hg=0,792B, ПР Hg2Cl2.=1,3·10-18.
Равновесная концентрация ионов ртути(1) определяется как растворимость Hg2Cl2 при [Cl-]=0,1моль/л и составляет:
С(Hg22+)= ПР Hg2Cl2/[Cl-]2=1,3·10-18/(0,1)2=1,3·10-16моль/л.
Отсюда
ЕHg 22+/2Hg=0,792+0,059/2·lg1.3·10-16=0,323В.
 2018-02-20
2018-02-20 4380
4380
