При повышении степени окисления протекает процесс окисления, а само вещество является восстановителем. При понижении степени окисления протекает процесс восстановления, а само вещество является окислителем.
Описанный метод уравнивания ОВР носит название «метод баланса по степеням окисления».
Излагаемый в большинстве пособий по химии и широко используемый на практике метод электронного баланса для уравнивания ОВР можно применять с оговорками о том, что степень окисления не равна заряду.
2. Метод полуреакций.
В тех случаях, когда реакция протекает в водном растворе (расплаве), при составлении уравнений исходят не от изменения степени окисления атомов, входящих в состав реагирующих веществ, а от изменения зарядов реальных частиц, то есть учитывают форму существования веществ в растворе (простой или сложный ион, атом или молекула нерастворенного или слабодиссоциирующего в воде вещества).
В этом случае при составлении ионных уравнений окислительно-восстановительных реакций следует придерживаться той же формы записи, которая принята для ионных уравнений обменного характера, а именно: малорастворимые, малодиссоциированные и газообразные соединения следует писать в молекулярной форме, а ионы, не изменяющие своего состояния, - исключать из уравнения. При этом процессы окисления и восстановления записывают в виде отдельных полуреакций. Уравняв их по количеству атомов каждого вида, полуреакции складывают, умножив каждую на такой коэффициент, который уравнивает изменение заряда окислителя и восстановителя.
Метод полуреакций точнее отражает истинные изменения веществ в процессе окислительно-восстановительных реакций и облегчает составление уравнений этих процессов в ионно-молекулярной форме.
Поскольку из одних и тех же реагентов могут быть получены разные продукты в зависимости от характера среды (кислотного, щелочного, нейтрального), для таких реакций в ионной схеме, кроме частиц, выполняющих функции окислителя и восстановителя, обязательно указывается частица, характеризующая реакцию среды (то есть ион Н+ или ион ОН-, или молекула Н2О).
Пример 5. Используя метод полуреакций, расставьте коэффициенты в реакции:
KMnO4 + KNO2 + H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O.
Решение. Записываем реакцию в ионном виде, учитывая, что все вещества, кроме воды, диссоциируют на ионы:
MnO4- + NO2- + 2H+ ® Mn2+ + NО3-+ H2O
(K+ и SO42- остаются без изменения, поэтому в ионной схеме их не указывают). Из ионной схемы видно, что окислитель перманганат-ион (MnO4-) превращается в Mn2+-ион и при этом освобождаются четыре атома кислорода.
В кислой среде каждый освобождающийся окислителем атом кислорода связывается с 2Н+ с образованием молекулы воды.
Отсюда следует: MnO4- + 8H+ + 5 ® Mn2+ + 4H2O.
® Mn2+ + 4H2O.
Находим разницу зарядов продуктов и реагентов: Dq = +2-7 = -5 (знак "-" показывает, что протекает процесс восстановления и 5 присоединяется к реагентам). Для второго процесса, превращения NO2- в NO3-, недостающий кислород поступает из воды к восстановителю, и в результате образуется избыток ионов Н+, при этом реагенты теряют 2
присоединяется к реагентам). Для второго процесса, превращения NO2- в NO3-, недостающий кислород поступает из воды к восстановителю, и в результате образуется избыток ионов Н+, при этом реагенты теряют 2 :
:
NO2- + H2O - 2 ® NO3- + 2H+.
® NO3- + 2H+.
Таким образом получаем:
2 | MnO4- + 8H+ + 5 ® Mn2+ + 4H2O (восстановление),
® Mn2+ + 4H2O (восстановление),
5 | NO2- + H2O - 2 ® NO3- + 2H+ (окисление).
® NO3- + 2H+ (окисление).
Умножая члены первого уравнения на 2, а второго - на 5 и складывая их, получим ионно-молекулярное уравнение данной реакции:
2MnO4-+ 16H+ + 5NO2- + 5H2O = 2Mn2+ + 8H2O + 5NO3- + 10H+.
Сократив одинаковые частицы в левой и правой части уравнения, получаем окончательно ионно-молекулярное уравнение:
2MnO4- + 5NO2- + 6H+ = 2Mn2+ + 5NO3- + 3H2O.
По ионному уравнению составляем молекулярное уравнение:
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O.
В щелочной и нейтральных средах можно руководствоваться следующими правилами: в щелочной и нейтральной среде каждый освобождающийся окислителем атом кислорода соединяется с одной молекулой воды, образуя два гидроксид-иона (2ОН-), а каждый недостающий – поступает к восстановителю из 2-х ОН--ионов с образованием одной молекулы воды в щелочной среде, а в нейтральной - поступает из воды с освобождением 2-х ионов Н+.
Если в окислительно-восстановительной реакции участвует пероксид водорода (Н2О2), надо учитывать роль Н2О2 в конкретной реакции. В Н2О2 кислород находится в промежуточной степени окисления (-1), поэтому пероксид водорода в окислительно-восстановительных реакциях проявляет окислительно-восстановительную двойственность. В тех случаях, когда Н2О2 является окислителем, полуреакции имеют следующий вид:
Н2О2 + 2Н+ + 2? ® 2Н2О (кислая среда);
Н2О2 +2? ® 2ОН-(нейтральная и щелочная среды).
Если пероксид водорода является восстановителем:
Н2О2 - 2? ® О2 + 2Н+ (кислая среда);
H2O2 + 2OH-- 2? ® O2 + 2H2O (щелочная и нейтральная).
Пример 6. Уравнять реакцию: KI + H2O2 + H2SO4 ® I2 + K2SO4 + H2O.
Решение. Записываем реакцию в ионном виде:
I- + H2O2 + 2H+ ® I2 + SO42- + H2O.
Cоставляем полуреакции, учитывая, что H2O2 в этой реакции является окислителем и реакция протекает в кислой среде:
 1 2I- - 2
1 2I- - 2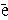 = I2 ,
= I2 ,
1 H2O2 + 2H+ + 2 ® 2H2O.
® 2H2O.
Конечное уравнение: 2KI + H2O2 + H2SO4 ® I2 + K2SO4 + 2H2O.
Различают четыре типа окислительно-восстановительных реакций:
1. Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени окисления атомов элементов, входящих в состав разных веществ. Реакции, рассмотренные в примерах 2-6, относятся к этому типу.
2. Внутримолекулярные окислительно-восстановительные реакции, при которых степень окисления изменяют атомы разных элементов одного и того же вещества. По такому механизму протекают реакции термического разложения соединений. Например, в реакции
+5 -2 +4 0
Pb(NO3)2 ® PbO + NO2 + O2
изменяет степень окисления азот (N+5 ® N+4) и атом кислорода (О-2 ® О20), находящиеся внутри молекулы Pb(NO3)2.
3. Реакции самоокисления-самовосстановления (диспропорционирования, дисмутации). В этом случае степень окисления одного и того же элемента и повышается, и понижается. Реакции диспропорционирования характерны для соединений или элементов веществ, соответствующих одной из промежуточных степеней окисления элемента.
Пример 7. Используя все выше изложенные методы, уравнять реакцию:
K2MnO4 + H2O ® KMnO4 + MnO2 + KOH.
Решение.
а) Метод баланса степеней окисления.
Определим степени окисления участвующих в окислительно-восстановительном процессе элементов до и после реакции:
+6 +7 +4
K2MnO4 + H2O ® KMnO4 + MnO2 + KOH.
Из сравнения степеней окисления следует, что марганец одновременно участвует в процессе окисления, повышая степень окисления с +6 до +7, и в процессе восстановления, понижая степень окисления с +6 до +4.2 Mn+6 ® Mn+7; Dw = 7-6 = +1 (процесс окисления, восстановитель),
1 Mn+6 ® Mn+4; Dw = 4-6 = -2 (процесс восстановления, окислитель).
Поскольку в данной реакции окислителем и восстановителем выступает одно и то же вещество (K2MnO4), коэффициенты перед ним суммируются. Записываем уравнение:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH.
б) Метод полуреакций.
Реакция протекает в нейтральной среде. Составляем ионную схему реакции, учитывая при этом, что Н2О является слабым электролитом, а MnO2 - малорастворимый в воде оксид:
MnO42- + H2O ® MnO4- + ¯MnO2 + OH-.
Записываем полуреакции:
2 MnO42- -? ® MnO4- (окисление),
1 MnO42- + 2Н2О + 2? ® MnO2 + 4ОН- (восстановление).
Умножаем на коэффициенты и складываем обе полуреакции, получаем суммарное ионное уравнение:
3MnO42- + 2Н2О = 2MnO4- + MnO2 + 4OH-.
Молекулярное уравнение: 3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH.
В этом случае K2MnO4 является одновременно и окислителем, и восстановителем.
4. Внутримолекулярные реакции окисления-восстановления, в которых происходит выравнивание степеней окисления атомов одного и того же элемента (то есть обратные ранее рассмотренным), являются процессами контрдиспропорционирования (коммутации), например
-3 + 3 0
NH4NO2 ® N2 + 2H2O.
1 2N-3 - 6? ® N20 (процесс окисления, восстановитель),
1 2N+3 + 6?® N20 (процесс восстановления, окислитель).
Наиболее сложными являются окислительно-восстановительные реакции, в которых окислению или восстановлению подвергаются одновременно атомы или ионы не одного, а двух или нескольких элементов.
Пример 8. Используя вышеизложенные методы, уравнять реакцию:
+3 -2 +5 +5 +6 +2
As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO.
 2014-02-02
2014-02-02 19053
19053
