Алгоритм розв’язку задач за цим способом:
1. Записуємо скорочену умову задачі.
2. Визначаємо речовину, яка перебуває в недостачі, обчислюємо кількості вихідних речовин за умовою задачі.
3. Записуємо хімічне рівняння реакції, складаємо мольні відношення вихідних речовин та порівнюємо отримані результати.
4. Розрахунки проводимо за речовиною, що перебуває в недостачі.
Задача. Обчисліть об’єм водню, що утвориться в результаті взаємодії цинку масою 13 г із сульфатною кислотою масою 20 г.
 Дано:Розв’язання
Дано:Розв’язання
13 г 20г X л
Zn + H2SO4= ZnSO4+ H2
n =1моль n =1моль n =1моль
m =65г m =98г V =22,4л
1. Знаходимо вихідну речовину. Позначаємо одну з відомих величин через Y. Нехай m (H2SO4) = Y (г).

Оскільки з 13 г Zn може повністю прореагувати 19,4 г H2SO4, то кислота дана в надлишку, цинк — у недостачі, а отже, є вихідною речовиною.
2. Визначаємо, який об’єм водню виділиться.
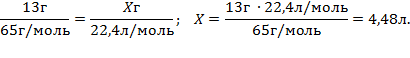
Відповідь: V (H2) = 4,48(л).
Задачі для самостійного розв’язування
1. До розчину, що містить натрій ортофосфат масою 20 г, додали кальцій хлорид масою 22,2 г. Яка маса осаду утвориться при цьому?
2. Яку масу сульфур діоксиду можна одержати із сірки масою 10 г і кисню об’ємом 5,6 л (н.у.)?
3. Яку масу алюміній сульфіду можна одержати під час сплавлення 8,1 г алюмінію з 9,6 г сірки? Яка речовина і з якою масою не прореагує?
 2018-02-13
2018-02-13 355
355








