Различие и многообразие кристаллических структур зависят от многих факторов: химической природы вещества, размеров атомов и ионов, сил связи между ними. Кристаллохимические радиусы (расстояния между ближайшими атомами в кристаллических структурах) равны сумме радиусов атомов.
Рассмотрим структуру ионного кристалла (рис. 6.2). Между ионами действуют силы притяжения и силы отталкивания. Существует некоторое минимальное расстояние, на котором сила взаимодействия равна нулю. Это расстояние соответствует постоянной кристаллической решётки. Центры ионов находятся друг от друга на этом минимальном расстоянии. Легко представить себе простую картину ионной структуры как упаковку соприкасающихся несжимаемых сфер. Вокруг катиона в структуре флюорита располагается группа из восьми анионов. «Радиус» каждого данного иона зависит от рассматриваемого химического элемента и от величины его электростатического заряда. Радиус мал для положительно заряженных ионов – катионов – и велик для отрицательно заряженных ионов – анионов.
Эффективный радиус иона конкретного элемента зависит от степени заполнения электронами электронных оболочек, атомного номера элемента и степени ионизации элемента.
Размеры ионных радиусов всех элементов подчиняются следующим закономерностям.
1. Внутри одного вертикального ряда радиусы ионов увеличиваются
с возрастанием атомного номера в связи с возрастанием числа электронных
оболочек.
2. Для одного и того же элемента ионный радиус возрастает с увеличением
отрицательного заряда и уменьшается с увеличением положительного заряда
(рис. 6.3).
3. Размеры атомов и ионов увеличиваются с увеличением номера элемента
(кроме ряда лантанидов и актинидов, где с увеличением номера элемента они
уменьшаются).
Изображение структуры в виде упаковки сфер может быть полезным, даже если в структуре действуют другие химические связи. Эффективный радиус атома (несжимаемого шара) – это радиус сферы его действия. Атомные радиусы в структурах простых веществ (элементов) с металлической или ковалентной связью равны половине кратчайшего межатомного расстояния (рис. 6.3).
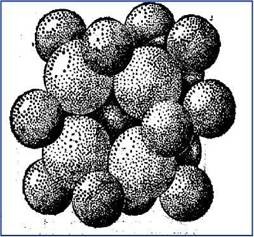
Рис. 6.2. Упаковка ионов в структуре флюорита
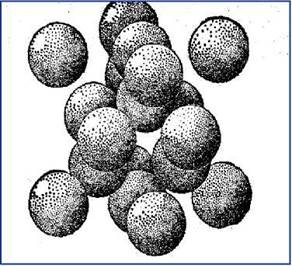
Рис. 6.3. Упаковка атомов в структуре алмаза
Эффективный радиус атома конкретного элемента зависит от степени заполнения электронами электронных оболочек, от атомного номера элемента и степени ионизации элемента. Во многих симметричных структурах с гомеополярной или металлической связью половину расстояния между центрами одинаковых атомов можно считать радиусом соответствующих атомов.
Атомные и ионные радиусы определены экспериментально по рентгеновским измерениях межатомных расстояний и вычислены теоретически на основе квантово-механических представлений. В настоящее время существуют таблицы кристаллохимических радиусов для всех типов связей.
 2020-01-15
2020-01-15 386
386








