КРИСТАЛЛОГРАФИЯ
СИММЕТРИЯ
Лекция 6
Лекция 6
Кристаллохимия
Содержание
6.1. Кристаллохимическое описание атомной структуры.
6.2. Ионные и атомные радиусы.
6.3. Координационное число и координационный многогранник.
6.4. Стехиометрическая формула вещества.
6.5. Плотные упаковки частиц в структурах.
6.6. Построение структур с помощью координационных полиэдров.
6.7. Основные типы структур.
Кристаллохимическое описание атомной структуры
Кристаллохимия – раздел кристаллографии, в котором изучаются закономерности расположения атомов в кристаллах и природа химической связи между ними. Кристаллохимия основана на обобщении результатов экспериментальных дифракционных методов исследований атомной структуры кристаллов; классических и квантовых теориях химической связи; расчётах энергии кристаллических структур с учётом симметрии кристаллов.
Кристаллохимические закономерности позволяют объяснить и в ряде случаев предсказать расположение атомов или молекул в кристаллической структуре и расстояния между ними. Химическая связь между атомами в кристаллах возникает за счёт взаимодействия внешних валентных электронов атомов, тогда как внутренние электронные оболочки практически остаются неизменными.
Равновесное расстояние между атомами обычно составляет 0,15–0,40 нм (в зависимости от типа химической связи). Это позволяет в первом приближении приписать атомам разного типа связи определённые «размеры», т. е. некоторые постоянные радиусы, а за счёт этого перейти от физической модели кристалла как атомноэлектронной системы к его геометрической модели как системе несжимающихся шариков.
Полное кристаллохимическое описание атомной структуры любого кристалла включает указание: размеров элементарной ячейки; пространственной группы симметрии кристалла; координат атомов; расстояний между ними; типа химической связи; окружения атомов; характерных атомных группировок; тепловых колебаний атомов.
По характеру химической связи кристаллы делятся на четыре основные группы: ионные кристаллы; ковалентные (алмаз, кремний); металлические (металлы и интерметаллические соединения); молекулярные кристаллы (нафталин).
В ионных кристаллах внешние валентные электроны переходят от атомов металлов, которые становятся положительными ионами (катионами), к атомам неметаллов, которые становятся отрицательными ионами (анионами), что приводит к электростатическому притяжению между ними. Взаимодействие ионов является кулоновским, но при их соприкосновении начинают играть роль силы отталкивания между электронными оболочками.
В случае ковалентной связи пары валентных электронов соседних атомов обобществляются, образуя «мостики» электронной плотности между связанными атомами. Силы взаимодействия между атомами являются направленными и имеют квантово-механическую природу.
Природа металлической связи та же, что и ковалентной, т. е. обобществление внешних валентных электронов атомов. Однако характер локализации этих электронов иной: они приблизительно равномерно заполняют всё межатомное пространство, образуя общий электронный «газ». Электронный газ осуществляет коллективное взаимодействие с заряженными положительно остатками атомов металла.
В молекулярных кристаллах атомы внутри молекул объединены прочными ковалентными связями, а атомы соседних молекул взаимодействуют за счёт более слабых ван-дер-ваальсовых сил, имеющих дипольное и дисперсионное происхождение (рис. 6.1).
Во многих кристаллах связь имеет промежуточный характер (например, в кристаллах силикатов она ионно-ковалентная, у полупроводников связь в основном ковалентная, но с примесью ионной и металлической).
В некоторых кристаллах (например, лёд, органические кристаллы) существует водородная связь.
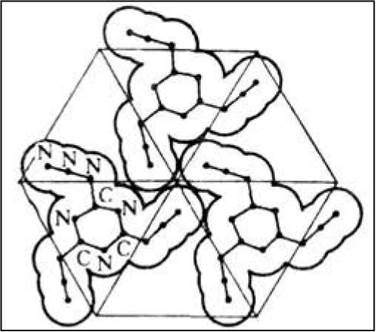
Рис. 6.1.Упаковка молекул триазидциануровой кислоты в кристалле
Некоторым кристаллам свойственно образовывать разные кристаллические структуры при изменении термодинамических условий (проявление полиморфизма). Обычно, чем проще формула соединения, тем более симметрична его структура. Кристаллы со сходной химической формулой (в смысле числа и соотношения различных атомов) могут иметь одинаковую кристаллическую структуру, несмотря на различие типов связи - это явление названо изоструктурностью.
Изоструктурны: галогениды щелочных металлов типа NaCl; некоторые окислы (например, MgO); ряд сплавов (например, Ti-Ni). Существуют большие серии изоструктурных соединений с формулами вида АВ2, АВ3, АВХ3 и т. п. Если кристаллы изоструктурны и обладают одинаковым типом связи, их называют изоморфными. Во многих случаях между изоморфными кристаллами возможно образование непрерывного ряда твёрдых растворов.
В геометрической модели кристаллической структуры кристаллохимия использует концепцию эффективных радиусов атомов, ионов и молекул.
 2020-01-15
2020-01-15 357
357







