2.2.1. Атомы радиоактивного изотопа тория 232Th испускают α – ча- стицы. Получающиеся при этом атомы другого изотопа ис- пускают β – лучи. Какой изотоп образуется в результате этих двух последовательных превращений? Напишите уравнения соответствующих ядерных реакций.
Решение: Ядерные реакции записывают с помощью уравне ний, подобных обычным химическим уравнениям, однако приводимые в этих уравнениях химические символы обозна- чают не атомы элементов, а лишь их ядра. При составлении ядерных реакций соблюдается равенство суммы зарядов и массовых чисел в левой и правой частях уравнения. При этом заряд элек трона учитывается со знаком минус, протона – со знаком плюс. Нейтрон и γ – квант заряда не имеют. Кроме то- го, массы электронов и γ – квантов не учитываются. В данном примере нужно определить, ядро какого элемента получится в
результате ядерной реакции: 232 Th ® 4 He + ...
90 2
Массовое число в левой части равно 232. В силу пра- вила равенства сумм массовых чисел в правой части уравнения сумма массовых чисел частиц должна быть 232, значит, массовое число нового элемента 228. Суммарный заряд в правой части уравнения должен быть 90, а α –частица имеет заряд +2, значит новый элемент имеет заряд +88; этим элементом будет изотоп
228Ra. Ядерная реакция в полном виде: 232 Th ® 4 He + 228 Ra
Полученный изотоп
228
88
90 2 88
испускает β – лучи (электрон)
Ra
и получится изотоп актиния
228 Ac.: 228 Ra ® 0 e + 228 Ac.
89 88 -1 89
2.2.2.
S
Константа радиоактивного распада k радиоизотопа 35
16
равна 9,21· 10-8 с-1. Определите период полураспада и среднюю продолжительность жизни.
Решение: Согласно закону радиоактивного распада скорость радиоактивного распада изотопа пропорцио- нальна общему числу атомов этого изотопа. Матема- тически этот закон выражается соотношением
Nτ = N0 · е -kτ
где N0 – исходное число радиоактивных атомов в
начальный момент распада; Nτ – число радиоактивных
атомов по истечении времени распада τ; e – основание натурального логарифма, равное 2,718; k – константа радиоактивного распада, характеризующая относи- тельную долю атомов изотопа, распадающихся в еди- ницу времени. На основе закона радиоактивного рас- пада устанавливается взаимосвязь между основными кон- стантами радиоизотопа τ1/2, k. Константа радиоактивного рас- пада k радиоизотопа связана с периодом полураспада соотно-
шением:
t = 0, 693.Период полураспада τ1/2 – время, в течении

1/ 2 k
которого распадается половина первоначального количества
радиоизотопа:
t 1/ 2
= 0, 693
 9, 21×10-8
9, 21×10-8
= 0, 075 ×108 cч = 2, 08 ×103.
Средняя про-
должительность жизни радиоизотопа τ = 1/k, τ – время, необ- ходимое для полного разложения любого количества радио- изотопа при постоянной скорости распада:
 t = 1 =
t = 1 =
k
1
 9, 21×10-8
9, 21×10-8
= 0,108 ×108 с = 3×103 ч.
2.2.3. Период полураспада радиоизотопа равен 14 суткам. Сколько атомов этого радиоизотопа распадается за сутки, если число атомов равно 1020?
Решение: Из определения периода распада следует, что с каждым периодом распада количество изотопа уменьшается в 2 раза. Следовательно, если пройдет n периодов полураспада, то количество радиоизотопа уменьшится в 2n раз. После n пе- риодов полураспада неразложившимся останется следующее
число атомов радиоизотопа Nτ =N0 · 2–n,
n = t .
 t 1
t 1
2
Аналогичное соотношение имеет место и в случае выражения количества радиоизотопа не числом атомов, а в массовых еди- ницах: mτ= m0· 2-n.
Для данного примера:
 t 1 20 20 -1
t 1 20 20 -1
 n = t
n = t
ат=омов;;
NN0 = 1100 2;
t = × 14
1/ 2 14
 |
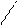 lg N = 20 lg 10 - 1 lg 2 = 20 ×1- (1) × 0, 3010 = 20 - 0, 0215 = 19, 9785;
lg N = 20 lg 10 - 1 lg 2 = 20 ×1- (1) × 0, 3010 = 20 - 0, 0215 = 19, 9785;
t 14 14
Nτ = 9,516·1019 атомов.
Через сутки останется 9,516·1019 неразложившихся атомов. За сутки разложилось 10·1019 - 9,516·1019 = 0,484·1019 атомов.
2.2.4. Природный галлий представляет собой смесь изотопов 69Ga и
71Ga. На основании относительной атомной массы природного
галлия Ar (Ga) =69,72 определите изотопный состав галлия в
% по массе.
Решение: Пусть 1 моль галлия содержит x моль изотопа 69Ga и (1- х) моль изотопа 71Ga. Масса 1 моля галлия равна 69,72 г., поэтому:
69 х + 71· (1- х) = 69,72
х = 0,64
Массовые доли изотопов составляют:
w (71 Gaи) л = 71× 0, 36 = 0, 3666, 36, 66%; w (69 Gaи) л = 69 × 0, 64 = 0, 6334 , 63, 34%.
и
69, 72
и
69, 72
 2020-01-15
2020-01-15 122
122








