2.3.1. Основываясь на положении в периодической системе водоро- да, гелия, азота, серы, кальция, платины, определите: а) заряд ядра атома; б) число нуклонов в ядре; в) число протонов и нейтронов в ядре.
2.3.2. В какой элемент превращается радий, испуская одну α – ча- стицу? Составьте уравнение ядерной реакции.
2.3.3. При действии α – частиц на 14 N образуется изотоп другого элемента и протон. Составьте уравнение ядерной реакции.
2.3.4. Изотоп какого элемента получится при потере атомом тория
(232) пяти α – и двух β – частиц? Какова будет атомная масса этого изотопа?
2.3.5. Ядро атома элемента содержит 10 нейтронов. Электронная оболочка атома содержит 9 электронов. Какой это элемент?
2.3.6. Масса ядра атома некоторого изотопа равна 181 а.е.м. В элек- тронной оболочке атома содержится 73 электрона. Укажите: а) сколько протонов и нейтронов содержится в ядре атома; б) ка- кой это элемент?
2.3.7. Изотоп урана 238U, выделяя одну α – частицу, превращается в изотоп другого элемента. Какой элемент образуется?
2.3.8. Изотоп нептуния 239Np в результате ядерного распада превра- щается в изотоп плутония 239Pu. Какая частица при этом ис- пускается?
2.3.9. Изотоп урана 234U в результате ядерного распада превращает- ся в изотоп тория 230Th. Какая частица при этом испускается?
2.3.10. Закончите уравнения следующих ядерных реакций:
| а) 12 C + 1 n = 9 Be +... 6 0 4 б) 27 Al + 4 He ® 30 P +... 13 2 15 в)...+ 2 H ® 13 N + 1 n 1 7 0 | г) 239 Pu +... ® 240 Cm + 3 1 n 94 96 0 д)... + 1 n ® 4 He + 52 V 0 2 23 ж)..... + 1 P ® 2 4 He 1 2 |
2.3.11.
|
|
ции. Какая вторичная частица выделяется в результате этой реакции?
2.3.12.
|
чивое промежуточное ядро, для которого характерен элек- тронный β – распад. Составьте уравнение ядерной реакции с указанием промежуточного ядра.
2.3.13.
|
полураспада и средняя продолжительность жизни радиоизо- топа?
2.3.14. Средняя продолжительность жизни радиоизотопа свинца 210Pb равна 109 с. Вычислите константу радиоактивного распада (с-1) и период полураспада (в годах).
2.3.15. Какова масса разложившегося радия (229Ra), если первона- чальная масса его равна 1 г, а период полураспада 226Ra равен 1617 лет, время распада 10000 лет?
2.3.16. Какова была первоначальная масса образца 60Со, если после 25 лет его хранения разложилось 1,25 кг? Период полураспада 60Со равен 5,27 лет.
2.3.17. В природной смеси хлора на 1 атом нестабильного изотопа 37Cl приходится 3 атома стабильного изотопа 35Cl. Какова от- носительная атомная масса хлора, если точные массовые чис- ла изотопов: 37Cl – 36,9659, 35Cl – 34,9689?
2.3.18. Относительная атомная масса рубидия равна 85,47. Природная смесь рубидия состоит из стабильного изотопа 85Rb и радиоак- тивного изотопа 87Rb. Сколько процентов по массе каждого изотопа находится в природной смеси рубидия, если точные массовые числа изотопов: 85Rb – 84,9117, 87Rb – 86,9092?
2.3.19. Природный неон состоит из 90 масс.% изотопа 20Ne и 10 масс.% изотопа 22Ne. Рассчитайте среднюю атомную массу неона.
2.3.20. Существуют ли элементы, ядра атомов которых содержали бы протонов больше, чем нейтронов? Ответ дать на основе анали- за таблицы Д.И. Менделеева.
2.3.21. Можно ли ожидать открытия новых элементов, которые будут размещены в первом периоде?
2.3.22. Какие типы и числа орбиталей отвечают n, равному 1,2,3,4? Значениями каких квантовых чисел они определяются?
2.3.23. Сколько электронных уровней содержат атомы с порядковы- ми номерами 17 и 20?
2.3.24. Составьте электронную формулу элемента, на третьем уровне которого расположены 10 электронов.
2.3.25. Какие типы подуровней заняты валентными электронами у атомов элементов с порядковыми номерами 13,19 и 21?
2.3.26. Составьте электронные формулы элементов с порядковыми номерами 13, 15,17,23,24,25,29,31,33,36,51. Укажите валент- ные электроны.
2.3.27. На скольких энергетических уровнях расположены электроны в атомах стронция, бария, селена, ванадия?
2.3.28. Сколько электронов содержат на внешнем уровне атомы сле- дующих элементов: хлора, брома, иода, азота, фосфора, мы- шьяка, сурьмы, хрома, железа, марганца?
2.3.29. Каково строение электронного уровня атома серебра с n = 4?
2.3.30. Сколько электронов на 5d подуровне атома ртути?
2.3.31. Каким элементам соответствуют следующие электронные формулы:
а) 1s22s22p5; б) 1s22s22p0; в) 1s22s22p63s23p53d0; г) 1s22s22p63s23p4;
д) 1s22s22p63s23p63d54s1?
2.3.32. Сколько всего электронов у элементов, валентные электроны которых находятся на следующих подуровнях: а) … 2s22p5; б) … 3s23p03d0; в) …3d84s24p04d04f0?
2.3.33. 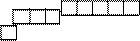


|
2.3.34. На каких подуровнях находятся валентные электроны в ато- мах элементов VI группы?
2.3.35. Для атома бора возможны два различных электронных состо- яния, выраженных следующими электронными формулами: 1s22s22p0 и 1s22s12p1. Как называются эти состояния атома? Как перейти от первого ко второму?
2.3.36. Сколько неспаренных электронов содержится в основном со- стоянии в электронных оболочках атомов углерода, хрома, фосфора, серы, неона?
2.3.37. Сколько свободных d-орбиталей содержится в основном со- стоянии в электронных оболочках атомов ванадия, титана, скандия?
2.3.38. Сколько свободных f-орбиталей содержится в атомах элемен- тов с порядковыми номерами 59, 60, 90, 93? Напишите элек- тронные формулы этих элементов.
2.3.39. Сколько электронов содержат в наружном слое следующие ионы IV периода: Ca2+, Zn2+, Cr3+, Se2-, Br-1? Какие из них сходны по строению электронной оболочки с атомами инерт- ных газов?
2.3.40. Составьте электронные и электронно-ячеечные формулы сле- дующих ионов: Na+, Mg2+, Sr2+, O2‾, Cl‾, P3‾. Какие из них сходны по строению электронной оболочки с атомом неона?
2.3.41. Объясните, с чем связан резкий скачок в изменении величины потенциала ионизации при переходе от четвертого к пятому потенциалу атома С:
| Потенциал | I1 | I2 | I3 | I4 | I5 |
| ионизации, эВ | 11, | 22, | 4 | 6 | 392 |
2.3.42. Как изменяется потенциал ионизации в группе щелочных металлов?
2.3.43. Почему у d- элементов потенциалы ионизации по периоду изменяются в меньшей степени, чем у p- элементов?
2.3.44. Чем обусловлена немонотонность изменения потенциалов ионизации по периоду?
2.3.45. Почему металлические свойства Са выражены сильнее, чем Zn?
2.3.46. В атоме какого элемента лития или цезия связь валентного электрона с ядром сильнее? Поясните почему.
2.3.47. Поясните наблюдаемую закономерность в изменении потен- циалов ионизации элементов II периода:
| Li | Ве | В | С | N | О | F | Nе | |
| I,эВ | 5.39 | 9.32 | 8.29 | 11.26 | 14.53 | 13.61 | 17.42 | 21.56 |
2.3.48. Расположите по мере возрастания потенциалов ионизации сле- дующие атомы: 1) 1s2, 2) 1s22s22p2, 3) 1s22s22p5, 4) 1s22s22p6, 5) 1s22s22p63s1.
2.3.49. Как изменяются атомные радиусы элементов по периоду и группе? Монотонно ли они изменяются по периоду?
2.3.50. Определите максимальные значения положительной и отри- цательной степени окисления следующих элементов: азота, хлора, хрома, натрия, фосфора, водорода.
Химическая связь
Важнейшие понятия. Основные особенности химического взаи- модействия (химической связи) и механизм образования химической связи. Насыщаемость и направленность химической связи. Квантово- механическая трактовка механизма образования связи в молекуле во-
дорода.
Основные типы химической связи:ковалентная (неполярная и полярная), ионная, металлическая. Основные положения теории ва- лентных связей (ВС). Особенности образования связей по донорно- акцепторному механизму.
Валентность химических элементов. Валентность с позиции тео- рии ВС. Валентность s-, p-, d-, f -элементов. Постоянная и переменная валентности. Валентность и степень окисления атомов элементов в их соединениях.
Координационное число химически связанного атома как харак- теристика, дополняющая валентность. Понятие о валентной и коорди- национной насыщенности.
Одиночные и кратные связи. s- и p-связи - разновидности кова- лентных и полярных связей.
Количественные характеристики химических связей. Порядок связи. Энергия связи. Длина связи. Валентный угол. Степень ионности связи. Эффективные заряды химически связанных атомов и степень ионности связи. Дипольный момент связи. Степень ионности связи как функция разности электроотрицательности взаимодействующих ато- мов.
Концепция гибридизации атомных орбиталей и пространствен- ное строение молекул и ионов. Особенности распределения электрон- ной плотности гибридных орбиталей. Простейшие типы гибридиза- ции: sp, sp2, sp3, sp3d2. Гибридизация с участием неподеленных элек- тронных пар. Влияние отталкивания электронных пар на простран- ственную конфигурацию молекул (теория ОВЭП).
Теория молекулярных орбиталей (МО). Основные положения теории МО. Энергетическая диаграмма. Связывающие и разрыхляю- щие МО. Энергетические диаграммы МО двухатомных молекул эле- ментов 2-го периода. s - и p-МО. Относительная устойчивость двух- атомных молекул и соответствующих молекулярных ионов. Сравнение теорий ВС и МО.
Силы Ван-дер-Ваальса. Ориентационное, индукционное и дис- персионное взаимодействия. Факторы, определяющие энергию меж- молекулярного взаимодействия. Энергия межмолекулярного взаимо- действия в сравнении с энергией химического взаимодействия.
Водородная связь. Природа водородной связи, ее количествен- ные характеристики. Меж- и внутримолекулярная водородная связь. Водородная связь между молекулами фтороводорода, воды, аммиака. Соединения включения. Клатратные соединения.
Кристаллическое состояние вещества. Деление кристаллов по типу связи: атомные (ковалентные), ионные, металлические, молеку-
лярные. Факторы, определяющие температуру плавления ионных, атомных и молекулярных кристаллов.
Зависимость физических свойств веществ с молекулярной струк- турой от характера межмолекулярного взаимодействия. Температуры плавления и кипения в рядах веществ сходного состава, образованных элементами одной подгруппы. Теплоты фазовых переходов. Влияние водородной связи на физические свойства веществ с молекулярной структурой. Особенности физических свойств молекулярных кристал- лов в сравнении с ионными и атомными кристаллами.
Вопросы
3.1.1. Какую химическую связь называют ковалентной? Как метод валентных связей (ВС) объясняет образование ковалентной связи?
3.1.2. Какие свойства ковалентной связи вы знаете? Чем можно объ- яснить направленность ковалентной связи?
3.1.3. Как метод ВС объясняет переменную спинвалентность угле- рода, серы, хлора и отсутствие переменной валентности у кис- лорода и фтора?
3.1.4. Что такое гибридизация валентных орбиталеи?
3.1.5. Каково взаимное расположение электронных облаков при sр3-гибридизации? Приведите примеры соединений с таким типом гибридизации атомных орбиталей и какова простран- ственная структура их молекул?
3.1.6. Как метод валентных связей (ВС) объясняет строение молеку- лы воды?
3.1.7. Как метод ВС объясняет линейное строение молекулы ВеСl2 и тетраэдрическое СН4?
3.1.8. Какие молекулы являются полярными и какие неполярными? Что служит количественной мерой полярности молекул?
3.1.9. Что следует понимать под степенью окисления атома?
3.1.10. Какие ковалентные связи называются s-,p- и d-связями? Какие электроны могут образовывать эти связи?
3.1.11. Разберите строение молекулы азота.
3.1.12. Какой способ образования ковалентной связи называют до- норно-акцепторным?
3.1.13. Какие химические связи имеются в ионах NH4+ и BF4─? Ука- жите донор и акцептор.
3.1.14. Какой способ образования ковалентной связи называют p - да- тивным?
3.1.15. В чем сущность метода молекулярных орбиталей (МО)?
3.1.16. Какие электроны в методе МО называют связывающими и ка- кие разрыхляющими?
3.1.17. Как метод МО объясняет парамагнитные свойства молекулы кислорода?
3.1.18. Какую связь называют ионной? Каковы ее свойства?
3.1.19. Приведите два примера типичных ионных соединений.
3.1.20. Что такое водородная связь? В каких случаях она образуется?
3.1.21. Какие силы межмолекулярного взаимодействия называют дисперсионными, ориентационными и индукционными? Ко- гда возникают эти силы и какова их природа?
3.1.22. Что называют электрическим моментом диполя?
3.1.23. Какие агрегатные состояния вещества вы знаете? Чем харак- теризуется каждое из них?
3.1.24. Какие типы кристаллических структур вы знаете?
3.1.25. Какие кристаллические структуры называют ионными, атом- ными, молекулярными и металлическими?
3.1.26. Что называется полиморфизмом и изоморфизмом?
3.1.27. Какую связь называют металлической?
3.1.28. Какие соединения называют клатратными (клатратами)?
3.1.29. Какую связь называют водородной?
3.1.30. Как влияет наличие дополнительных слабых взаимодействий на физические свойства веществ?
3.1.31 Каковы три основные проблемы теории химической связи?
3.1.32 Что такое поляризуемость частиц и поляризующая способ- ность ионов? Какова размерность поляризуемости? Что явля- ется мерой поляризации?
3.1.33. Зависимость коэффициента поляризации от заряда и радиуса иона, от электронной структуры частиц. Правила Фаянса.
3.1.34. Как меняется коэффициент поляризации сверху вниз по под- группе, по периоду?
3.1.35. От чего зависит деформирующее действие ионов? Какова роль ионного потенциала Z/R и электронной структуры иона.
3.1.36. Как, используя явление контрполяризации, объяснить разницу в температурах разложения карбонатов лития (600 0С) и кар- боната натрия (800 0С)?
3.1.37. Как влияет поляризация на тип химической связи в соедине- ниях однотипного состава? Почему отсутствует чисто ионная связь?
3.1.38. Влияние поляризационного воздействия на кристаллическую структуру веществ. Как объяснить большую разницу в темпе- ратурах плавления хлорида натрия (800 0С) и хлорида серебра (450 0С)?
3.1.39. Вклад поляризационных эффектов в окраску химических со- единений. Почему у сульфидов щелочных металлов по срав- нению с их оксидами слабее выражена ионная связь?
3.1.40. Как изменяется доля ионной связи в ряду молекул галогено- водородов?
3.1.41. Почему в ряду сульфатов щелочноземельных металлов темпе- ратуры плавления, как правило, растут с увеличением поряд- кового номера элемента?
3.1.42. Под влиянием какого воздействия происходит поляризация связей? Что при этом происходит с неполярными, полярными и сильно полярными связями?
3.1.43. Что такое гомолитический и гетеролитический разрыв связи? Какой из этих процессов для одинарной связи является более энергоемким?
3.1.44. Почему энергия связи между атомами в кристалле больше, чем энергия связи в молекуле?
3.1.45. Какие виды взаимодействия обеспечивают выигрыш в энергии при образовании химической связи?
3.1.46. Как изменяется возможность к проявлению максимальной ва- лентности у р- и d- элементов в пределах групп?
3.1.47. Чем отличается понятие «степень окисления» от понятий «ва- лентность», «эффективный заряд химически связанного ато- ма», «заряд иона»?
3.1.48. Объяснить линейную комбинацию р- орбиталей при образова- нии орбиталей σ- и π- симметрии.
3.1.49. Как согласовать малую полярность связи в молекуле СО (μ=0.1 Д) со значительным различием в электроотрицательно- сти углерода (ЭО=2.5) и кислорода (ЭО=3.5)?
3.1.50. Что дает возможность считать донорно-акцепторную связь разновидностью ковалентной связи?
3.1.51. Можно ли считать водородную связь разновидностью донор- но-акцепторной связи?
3.1.52. Чем отличается взаимодействие между молекулами за счет ван-дер-ваальсовских сил от химического взаимодействия?
3.1.53. Каковы условия гибридизации орбиталей?
3.1.54. Смешение орбиталей процесс эндотермический, почему обра- зование химической связи с их участием идет с выделением энергии?
3.1.55. Как влияет характер межмолекулярного взаимодействия на физические свойства веществ?
3.1.56. Какова прочность водородной связи по сравнению с другими видами связи?
3.1.57. Почему разница в теплотах парообразования фтороводорода и хлороводорода меньше по сравнению с той же величиной для воды и сероводорода?
3.1.58. Почему температура плавления галогенидов щелочных и ще- лочноземельных металлов выше чем у галогеноводородов?
3.1.59. Многоцентровые связи. Чем объяснить димеризацию молекул борана и хлорида алюминия?
 2020-01-15
2020-01-15 264
264








