3.2.1. Объясните с помощью метода валентных связей (ВС) строе- ние молекулы фтористого водорода HF.
|
 |  | ||||
 |
Рис.3.1. Образование молекулы HF

3.2.2. Объясните образование связей в ионе аммония NH4+. Решение. Связи в ионе аммония NH4+ показаны на схеме (рис.3.2):
2s 2p

| |||||||||||||||||||||||||
1s 1s
H+
1s
H H H
|

|
H ¾ N → H + или
|
(1) H (2)
|
¾ 
 N ¾ H
N ¾ H
|
H
Рис.3.2. Образование иона аммония NH4+.
Вторая форма записи предпочтительней, поскольку отражает установленную экспериментально равноценность всех четы- рех связей.
3.2.3. Объясните образование связей в молекуле H3N×BF3.
Решение. Образование связей в молекуле H3N×BF3 показано на рис.3.3.
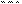
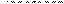
 Образование из молекул NH3 и BF3 более сложной молекулы H3N×BF3 объясняется с помощью образования связей по об- менному и донорно-акцепторному механизмам:
Образование из молекул NH3 и BF3 более сложной молекулы H3N×BF3 объясняется с помощью образования связей по об- менному и донорно-акцепторному механизмам:
| 2s | 2p | 2 | p | 2p | ||||||||||||
| ¯ | ¯ | ¯ | ¯ | F | ¯ | F | ¯ | |||||||||
| F | ||||||||||||||||
| | | | ||||||||||||||
| B* | ||||||||||||||||
| 2s | 2p | 2p | ||||||||||||||
| N | ¯ | | | | ||||||||||||
| 2s | ||||||||||||||||
| 1s | ¯ | ¯ | ¯ | |||||||||||||
| H | H | H |



 Структурная формула этой молекулы:
Структурная формула этой молекулы:
| F | H | F | H | ||
| | F ¾ B | | N | ¾ H | или F ¾ | | B | | ¾ N ¾ H |
| | | | | | | | | ||
| F | H | F | H |
Рис.3.3. Образование молекулы H3N×BF3.
3.2.4. Объясните с помощью метода ВС строение молекулы ВеF2. Решение. В молекуле ВеF2 в образовании химических связей участвуют 2s- и 2рx-орбитали возбужденного атома бериллия (рис.3.4.), которые перекрываются с соответствующими 2р- орбиталями атомов фтора.
В гибридизации участвуют одна 2s- и одна 2р-орбиталь атома
бериллия. Такой случай называется sр-гибридизацией. Угол между связями 180°, образуются две s-связи с участием од- ной s- и одной р-орбитали, и связи равноценны.
F 2s
2p
|
| |||||||||||||||||
| |||||||||||||||||
|
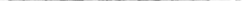 |
Рис. 3.4. Образование молекулы ВеF2
3.2.5. Объясните с помощью метода молекулярных орбиталей (МО) строение молекулы СО.
Решение. На рис.3.5 изображена энергетическая диаграмма молекулы СО. Электронная формула имеет вид:
[(s 1s)2 (s* 1s)2 (s 2s)2 (s* 2s)2 (p 2py)2 (p 2pz)2(s 2px)2].
 |
Рис.3.5. Энергетическая диаграмма молекулы CO
В связывающие орбитали больший вклад вносят орбитали кислорода, более электроотрицательного атома, а в разрых- ляющие - орбитали углерода, менее электроотрицательного атома. Кратность связи равна трем. Молекула диамагнитна.
 2020-01-15
2020-01-15 161
161








